2 Lección de química en octavo grado sobre el tema "Reacciones oxidativas-oxidativas"
Abstracto: Lección de química sobre el tema “Oxidación en reacciones positivas” para alumnos de 8º grado. Durante la lección, se revelan los conceptos básicos sobre reacciones oxidativas: etapa de oxidación, oxidación, reacción, oxidación, renovación: el almacenamiento de registros OVR se forma mediante el método de balanza electrónica.
Lección de química para octavo grado sobre el tema.
"Oxidativo en una reacción positiva"
META DE LA LECCIÓN: formular un sistema de conocimientos sobre reacciones oxidativas, aprender a compilar registros OVR utilizando el método de balanza electrónica.
OBJETIVO DE LA LECCIÓN:
Hogar: observar la esencia de los procesos de oxidación, aprender a definir la “etapa de oxidación” para identificar los procesos de oxidación y renovación; Aprenda a comparar registros de reacciones oxidativas utilizando el método del equilibrio electrónico.
Desarrollando: determinar cuidadosamente el tipo de reacción química, analizando la etapa de oxidación de los átomos en las sustancias; aprender conceptos, practicar algoritmos, destilar interés en un tema.
Vihovoyut: formular la necesidad de actividad cognitiva y valor del conocimiento; analiza las características de tus amigos, predice los resultados de tu trabajo, evalúa tu trabajo; Desarrollar una cultura de aprendizaje a través del trabajo en parejas “alumno-alumno”, “lector-alumno”.
Tipo de lección: Lección sobre el aprendizaje de material nuevo.
Métodos a utilizar en clase: Poyasnyuvalno-mula ilustrativa.
Entender qué presentar en clase: reacciones oxidativas; oxidante; a diario; proceso de oxidación; proceso de renovación.
Vikoristovuvane obladnannyata reacciona: tabla de divisiones, sistema periódico D. I. Mendeleev, ácido clorhídrico, ácido sulfúrico, gránulos de zinc, virutas de magnesio, sulfato de cobre, flores de malezas.
Forma robótica: Individuales, frontales.
Hora lectiva: (90 horas, 2 lecciones).
Progreso de la lección
I . Momento organizacional
II . Revisión del material cubierto.
LECTOR: Niños, repasemos el material sobre la etapa de oxidación, que necesitaremos en clase, antes de aprender.
Dormir frontalmente:
¿Qué es la electronegatividad?
¿Cuál es la etapa de oxidación?
¿Cómo se puede reducir a cero la etapa de oxidación de un elemento? ¿En qué tipo de situaciones?
¿Qué etapa de oxidación revela con mayor frecuencia la acidez en los espeleólogos?
Adivina la culpa.
¿Qué etapa de oxidación presentan los metales en compuestos polares e iónicos?
¿Cómo resolver la etapa de oxidación detrás de las fórmulas?
La etapa de oxidación del ácido siempre es superior a -2.
La etapa de oxidación del agua siempre puede aumentar a +1.
La etapa de oxidación de los metales es siempre positiva y, en la medida de lo posible, siempre es igual al número de grupo.
La etapa de oxidación de los átomos libres y de los átomos de compuestos simples siempre será 0.
La etapa de oxidación total de los átomos de todos los elementos de la especie dada es 0.
INSPECTOR presenta enseñanzas para consolidar las reglas de comprensión formuladas: conocer la etapa de oxidación de los elementos en palabras simples y medias palabras:
S, H 2, H 3 PO 4, NaHSO 3, HNO 3 Cu (NO 2) 2, NO 2 Ba, Al.
Por ejemplo: ¿Cuál será la etapa de oxidación del azufre en ácido sulfúrico?
En las moléculas, la suma algebraica de las etapas de oxidación de los elementos con el orden de su número de átomos es igual a 0.
H 2 +1 S x O 4 -2
(+1) * 2 + X * 1 + (-2). 4 = 0
X = + 6
H2+1S+6O4-2
III . Desarrollo de nuevo material.
LECTOR: La diversidad de clasificaciones de reacciones químicas con diferentes signos (directamente, el número y composición de las sustancias que reaccionan y coagulan, la proximidad del catalizador, el efecto térmico) Puedes agregar un signo más. Este signo es un cambio en la etapa de oxidación de los átomos de los elementos químicos que crean las sustancias que reaccionan.
Detrás de este signo se diferencian las reacciones.
Reacciones químicas
Reacciones que ocurren sin cambios Reacciones que ocurren sin cambios Etapa de oxidación de elementos Etapa de oxidación de elementos
Por ejemplo, la reacción
1 +5 -2 +1 -1 +1 -1 +1 +5 -2
AgNO3 + HCl AgCl + HNO3
Las etapas de oxidación de átomos de elementos químicos no cambiaron después de la reacción. Y el eje en la otra reacción es la interacción del ácido clorhídrico con el zinc.
2HCl + Zn ZnCl 2 + H 2
Los átomos de dos elementos, agua y zinc, cambiaron sus etapas de oxidación: el agua de +1 a 0 y el zinc de 0 a +2. Bueno, en esta reacción, el átomo de agua se elimina eliminando un electrón a la vez.
2H + 2eH2
y el átomo de la piel del zinc dio dos electrones
Zn-2е Zn
LECTOR:¿Qué tipos de reacciones químicas conoces?
APRENDER: Todas las reacciones de sustitución, así como aquellas reacciones de acoplamiento y expansión en las que participan, se llevan a cabo antes de la ORR. Me gustaría un discurso simple.
LECTOR: Fechas asignadas a OVR.
Las reacciones químicas que resultan en un cambio en las etapas de oxidación de los átomos de elementos químicos o iones que crean los compuestos que reaccionan se llaman oxidativo – nuevas reacciones.
LECTOR: Niños, comprendan que las reacciones provocadas por la oxidación no son positivas:
1) 2Na + Cl 2 = 2NaCl
2) Na CL + AgNO 3 = NaNO 3 +AgCl↓
3) Zn + 2HCl = ZnCl 2 + H 2
4) S + O 2 = ASI 2
UCHNI: viconuyut zadannya
LECTOR: La forma en que se aplica la OVR queda demostrada por la evidencia ofensiva.
H 2 SO 4 + Mg MgSO 4 + H 2
La etapa de oxidación de todos los elementos en las fórmulas de los reactivos y productos de esta reacción es significativa:
Como puede verse en una reacción similar, los átomos de dos elementos, magnesio y agua, cambiaron sus etapas de oxidación.
¿Que les pasó a ellos?
El magnesio de un átomo neutro se transforma en un ion metilo en el paso de oxidación +2, dando 2e:
Mg 0 - 2е Mg +2
Anota en tus notas:
Los elementos o palabras que proporciona la electrónica se llaman vidnovnikami; durante la reacción del hedor oxidar.
El ion mental H en la etapa de oxidación +1 se transformó en un átomo neutro, luego el átomo de la piel perdió un electrón a la vez.
2Н +1 +2е Н 2
Los elementos o discursos que aceptan electrónica se denominan oxidantes; durante la reacción del hedor estoy renovado.<Приложение 1>
Estos procesos se pueden presentar utilizando el siguiente diagrama:
Ácido clorhídrico + sulfato de magnesio magnesio + agua
CuSO 4 + Fe (flor carmesí) = Fe SO 4 + Cu (hermosa flor roja)
Fe 0 – 2 eFe +2
Cu +2 +2 eCu 0
El proceso de ceder electrones se llama oxidación, y aceptar - actualizaciones.
El proceso tiene una etapa de oxidación. avanzando, en proceso de renovación – está disminuyendo.
Estos procesos están indisolublemente ligados entre sí.
LECTOR: Echemos un vistazo a la historia y describámosla en detalle.
Zavdannya: Para reacciones óxido-óxido, seleccione el oxidante y el reactor, los procesos de oxidación y renovación, sume las ecuaciones electrónicas:
1) BaO + SO 2 = BaSO 3
2) CuCl 2 + Fe = FeCl 2 + Cu
3) Li + O 2 = Li 2 O 3
4) CuSO 4 + 2KOH = Cu(OH) 2 ↓ + K 2 SO 4
II parte de la lección (segunda lección)
El método del equilibrio electrónico como método para plegar los niveles OVR.
A continuación, veremos el nivel de reacciones oxidativas utilizando el método del balance electrónico. El método del balance electrónico se basa en la siguiente regla: el número total de electrones suministrados por el generador es igual a la misma cantidad de electrones suministrados por el oxidante.
Después de explicar la enseñanza bajo el cuidado del maestro, el OVR sigue los planes que el maestro les ha dicho antes de esta lección. <Приложение 2>.
Los recordatorios aparecen en el escritorio de cada estudiante.
LECTOR: Entre las reacciones que hemos desarrollado hasta reacciones óxido-óxido se encuentran:
Interacción metales con no metales
2Mg + O2 = 2MgO
Oxidación O 2 +4e 2O -2 1 actualización
2. Interacción metales del ácido.
H2SO4 + Mg = MgSO4 + H2
Vіdnovnik Mg 0 -2e Mg +2 2 oxidación
Oxígeno 2O -2 +4e O 2 0 1 actualización
3. Mutualismo metales de metales.
Cu SO 4 + Mg = MgSO 4 + Cu
Vіdnovnik Mg 0 -2e Mg +2 2 oxidación
Oxígeno Cu +2 +2e Cu 0 1 actualización
Se dicta la reacción, un científico elabora de forma independiente un esquema de reacción para la pizarra:
h 2 + oh 2 → h 2 oh
Es significativo que los átomos de algunos elementos cambien de etapa de oxidación.
(H 2 ° + O 2 ° → H 2 O 2).
Los procesos electrónicos de oxidación y renovación son complejos.
(H 2 ° -2e → 2H + - proceso de oxidación,
O 2 ° +4e → 2O - ² - proceso de renovación,
N 2 - vidnovnik, Pro 2 - oxidante)
Seleccionaremos una ubicación separada para la presentación y aceptación de los mismos coeficientes para cuentas electrónicas.
(∙2| Н 2 °-2е → 2Н + - proceso de oxidación, elemento – descendiente;
∙1| O 2°+4e → 2O - ² – proceso de renovación, elemento – oxidación).
Transfiramos estos coeficientes al nivel de OVR y seleccionemos coeficientes antes que las fórmulas de otros discursos.
2 h 2 + oh 2 → 2 h 2 oh .
IV . Asegurar el material atornillado
Derecho a fijar el material:
¿Qué esquema de transformación del nitrógeno es consistente con esta reacción similar?
4NH 3 +5O 2 → 4NO + 6H 2 O
1) norte +3 → norte +2 3) norte +3 → norte -3
2) N-3 → N-2 4) N-3 → N+2
2) Establecer el tipo entre cambiar la etapa de oxidación del átomo Sirki y el esquema de recreación del habla. Anota los números sin espacios y com.
ESQUEMA PEREVOREN
A) H 2 S + O 2 → ASI 2 + H 2 O
B) H 2 SO 4 + Na → Na 2 SO 4 + H 2 S + H 2 O
B) SO 2 + Br 2 + H 2 O → H 2 SO 4 + HBr
CAMBIO DE ETAPA DE OXIDACIÓN
1) Mi+4 → Mi+6
2) E+6 → E-2
3) Mi+6 → Mi+4
4) E-2 → E+6
5) Tipo E -2 → E +4 (521)
3) Establecer el tipo de transición entre el circuito y cambiar la etapa de oxidación. okislyuvac en su casa.
ESQUEMA PEREVOREN
A) Cl 2 + K 2 MnO 4 → KMnO 4 + KCl
B) NH 4 Cl + KNO 3 → KCl + N 2 O + H 2 O
B) HI + FeCl 3 → FeCl 2 + HCl + I 2
PASO ZMINA
OXIDACIÓN DE ÓXIDO
1) Mi+6 → Mi+7
2) E+5 → E+1
3) Mi+3 → Mi+2
4) E 0 → E-1
5) E -1 → E 0 tipo (423)
V. La última palabra del lector
Las reacciones oxidativas son la combinación de dos procesos de larga duración: oxidación y renovación. En estas reacciones, la cantidad de electrones que se dan a los oxidantes es igual a la cantidad de electrones que se agregan a los oxidantes. El mundo entero puede verse como un gigantesco laboratorio químico en el que tienen lugar reacciones químicas, principalmente reacciones oxidativas.
VI . Reflexión.
VIII . Mejoras para el hogar:§ 43, ej.1, 3, 7 páginas 234-235.
Literatura de Vikorystovuvan:
El nivel de oxidación de compuestos simples es igual a 0;
La etapa de oxidación de los metales en Estados Unidos es antigua.
1. Gabrielyan O.S. "Química. 8vo grado: nav. para retroiluminación. instalación -METRO. : Avutarda, 2010.
Reacciones de óxido. Khomchenko G.P., Sevastyanova K.I. - Instituto de Educación, 1985.
RECORDATORIO PARA ESTUDIANTES
Anexo No. 1
Los oxidantes y oxidantes más importantes.
|
amantes |
Oxígeno |
|
|
Metali, N 2, vugilla, CO – dióxido de carbono (II) Sales de H 2 S, SO 2, H 2 SO 3 HJ, HBr, HCl SnCl 2, FeSO 4, MnSO 4, Cr2(SO4)3 HNO 2 - ácido nitroso NH 3 – amoníaco NO - óxido de nitrógeno (II) Aldehídos, alcoholes, murashina y ácido oxálico, Cátodo durante la electrólisis |
Halógeno KMnO 4, K 2 MnO 4, MnO 2, K 2 Cr 2 O 7, K2CrO4 HNO 3 -ácido nítrico H 2 O 2 – peróxido de agua Pro 3 – ozono, Pro 2 H 2 SO 4 (conc.), H 2 S eO 4 CuO, Ag2O, PbO2 Iones de metales nobles (Ag+, Au3+) FeCl3 Hipoclorito, clorato y perclorato. "El Gorka del zar" Ánodo durante la electrólisis |
|
Anexo No. 2
Algoritmo para plegar balanzas químicas mediante el método de balanza electrónica:
1. Dibuja el diagrama de reacción.
2. Importancia de la etapa de oxidación de los elementos en los reactivos y productos de reacción.
¡Recordar!
número del grupo de estos metales (porI - III fanáticas).
Etapa de oxidación del átomo de oxidación en
juntos, llamen al viejo - 2, crema H 2 O 2 -1 y ОF 2.
Etapa de oxidación del átomo de agua en
en conexión entre sí, llame al anterior +1, crema MeH (hidruros).
Suma algebraica de pasos de oxidación.
los elementos de los conexos son iguales a 0.
3.Saber que la reacción es oxidativa-primaria o transcurre sin cambiar las etapas de oxidación de los elementos.
4. Subraya los elementos cuya etapa de oxidación cambia.
5. Variaciones de los procesos electrónicos de oxidación y renovación.
6. Esto significa qué elemento se oxida (su etapa de oxidación avanza) y qué elemento se reduce (su etapa de oxidación disminuye) durante el proceso de reacción.
7. En el lado izquierdo de los diagramas, indique el proceso de oxidación (reemplazo de electrones de un átomo de un elemento) y el proceso de renovación (reemplazo de electrones de un átomo de un elemento) detrás de las flechas.
8. Significativamente el oxidante y el oxidante.
9. Equilibrar el número de electrones entre el agente oxidante y el agente oxidante.
10. Importancia de los coeficientes de productos de oxidación y degradación, productos de oxidación y renovación.
11. Escriba el coeficiente antes de la fórmula del habla, lo que significa la parte media.
12. Verifique el nivel de reacción.
Anexo 3
Robot independiente para verificación de conocimientos.
Opción 1
1. Indique la etapa de oxidación de los elementos en las fórmulas, como IBr, TeCl 4, SeF e, NF 3, CS 2.
2. En los siguientes esquemas de reacción, indique la etapa de oxidación del elemento cutáneo y la distribución del coeficiente mediante el método del balance electrónico:
1) F 2 + Xe → XeF 6 3) Na + Br 2 → NaBr
2) S + H 2 → H 2 S 4) N 2 + Mg → Mg 3 N 2
opcion 2
1. Establecer la etapa de oxidación de los elementos en las siguientes posiciones: H 2 S O 4, HCN, HN O 2, PC1 3
2. Añadir la reacción de oxidación-renovación equivalente:
1) CI 2 + Fe → 2) F 2 + I 2 → 3) Ca + Z → 4) Z + H 2 →
Indique el estado de oxidación de los elementos en los productos consumidos.
Opción 3
1. Indique la etapa de oxidación de los compuestos, siendo las fórmulas XeF 4, CC 1 4, PC1 b, SnS 2.
2. Escriba la reacción equivalente: a) la descomposición del magnesio en la descomposición del ácido sulfúrico; b) interacción entre bromuro de sodio y cloro. ¿Qué elemento se oxida y cuál se renueva?
Opción 4
1. Sume las fórmulas de las siguientes fórmulas: a) nitruro de litio (litio con nitrógeno); b) sulfuro de aluminio (mitad aluminio y azufre); c) fluoruro de fósforo, en el que el elemento electropositivo presenta la etapa de oxidación máxima.
2. Escribe la reacción equivalente: a) yoduro de magnesio con bromo; b) la descomposición del magnesio a partir de la descomposición del ácido bromohidro. Explique que la lesión cutánea es oxidativa y que es regenerativa.
Opción 5
1. Sumar las fórmulas de los siguientes pasos: a) flúor con xenón; b) berilio con carbono, en el que el elemento electropositivo presenta la etapa de oxidación máxima.
2. Determine los coeficientes utilizando el método del balance electrónico para los siguientes esquemas:
1) KI + Cu(norte) Acerca de 3 ) 2 → CuI + I 2 +KN Acerca de 3
2) MnS+HN Acerca de 3 ( fin .) → mns Acerca de 4 +N Acerca de 2 +H 2 Acerca de
Opción 6
1. Ingrese las etapas de oxidación del elemento de la piel en las fórmulas, como Na 2 S O 3, KSYu 3, NaCIO, Na 2 Cr O 4, NH 4 ClO 4, BaMn O 4.
2. Escribe la reacción equivalente: a) yoduro de litio con cloro; b) litio con ácido clorhídrico. Ingrese a la etapa de oxidación de todos los elementos y coeficientes utilizando el método de equilibrio electrónico.
Opción 7
1. Calcular las etapas de oxidación del manganeso, cromo y nitrógeno en semiconductores, siendo las fórmulas KMnO 4, Na 2 Cr 2 Pro 7, NH 4 N Pro 3.
2. Establecer el nivel de oxidación del elemento de piel y la relación de coeficientes utilizando el método del balance electrónico de acuerdo con los siguientes esquemas:
2) H 2 S Pro 3 + I 2 + H 2 Pro → H 2 S Pro 4 + Hola
Opción 8
1. ¿Qué etapa de oxidación del carbono en óxido de carbono (IV) y qué cambios?
Las reacciones oxidativas ocurren antes de las reacciones químicas más amplias y son de gran importancia en la teoría y la práctica. Los procesos más importantes del planeta están relacionados con este tipo de reacciones químicas. La OVR ha corrompido a la humanidad durante mucho tiempo, inicialmente sin comprender su esencia. Recién a principios del siglo XX se creó la teoría electrónica de los procesos oxidativos. En esta lección, comprenderá los puntos principales de esta teoría, el método del equilibrio electrónico, aprenderá a formular una serie de reacciones químicas que ocurren en diferentes procesos y comprenderá cuál es el mecanismo de dichas reacciones.
Ventaja:
Vista delantera:
INSTALACIÓN DE ALUMBRADO MUNICIPAL
ESCUELA SECUNDARIA MUNICIPAL No. 5 m.
Lección sobre:
Reacciones de óxido.
profesora de química: Kisakova Olga Oleksandrivna
Hipoteca inicial municipal
escuela secundaria número 5,
m.Pit-Yakh, 2010
Tema de la lección: Reacciones de óxido.
Meta de la lección: Comprender, sistematizar y ampliar el conocimiento de los científicos sobre las reacciones óxido-óxido, los productos de oxidación más importantes y sus productos.
Zavdannya:
- Asegure la etapa de oxidación de elementos, oxidación y oxidación, y distribuya coeficientes mediante el método del balance electrónico.
- Para comprender mejor el poder óxido-hidróxido de los reactivos, predecir los productos de reacción depende de la actividad de los metales, la concentración de ácidos y la reacción de los medios.
- Es probable que se produzcan una serie de reacciones químicas similares a las que se encuentran en diversos medios que contienen manganeso.
- Muestre la diversidad y el valor de ODD en la naturaleza y la vida cotidiana.
- Continuar la preparación hasta el final del día con química.
Progreso de la lección
1. Momento organizacional
¡Buenas tardes! ¡Te daré un gran humor!
El tema de nuestra lección: “Reacciones oxidativas-oxidativas” (Presentación. Diapositiva 1)
Las reacciones oxidativas ocurren antes de las reacciones químicas más amplias y son de gran importancia en la teoría y la práctica. Los procesos más importantes del planeta están relacionados con este tipo de reacciones químicas. La OVR ha corrompido a la humanidad durante mucho tiempo, inicialmente sin comprender su esencia. Recién a principios del siglo XX se creó la teoría electrónica de los procesos oxidativos. En esta lección, comprenderá los puntos principales de esta teoría, el método del equilibrio electrónico, aprenderá a formular una serie de reacciones químicas que ocurren en diferentes procesos y comprenderá cuál es el mecanismo de dichas reacciones.
2. Repetición y escupitajo de material previamente tejido.
El tema de OVR no es nuevo para ti; debes seguirlo como un hilo conductor a lo largo de todo el curso de química. Por ello, os animo a repetir las acciones y conceptos sobre este tema.
Primera comida: “¿Cuál es la etapa de oxidación?” Sin este conocimiento, es imposible determinar las etapas de oxidación de los elementos químicos.
/ etapa de oxidación- esta es la carga mental de un átomo de un elemento químico, calculada sobre la base de una suposición, de modo que todos los resultados se suman a partir de iones. La etapa de oxidación puede ser positiva, negativa o incluso nula, dependiendo de la naturaleza de la especie.
Algunos elementos pasan por etapas graduales de oxidación, otros cambian.
Por ejemplo, a los elementos con una etapa de oxidación positiva constante se les atribuyen los siguientes metales: Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1 , los elementos actuales del grupo II de la tabla periódica:+2, Mg +2, Ca +2, Sr +2, +2, Ra +2, Zn +2 , así como el elemento III del grupo A - A1+3 y otras acciones. Los metales que se combinan siempre estarán en un estado positivo de oxidación.
Para los no metales, la etapa de oxidación negativa permanente (-1) es F.
En compuestos simples que contienen átomos de metales o no metales, la etapa de oxidación de los elementos es cero, por ejemplo: Na°, Al°, Fe°, H 2 0, 2 0, F 2 0, Cl 2 0, Br 2 0.
La etapa de oxidación característica del agua es: +1 (H 2 0) -1 (NaH).
La etapa de oxidación característica de la acidez es: -2 (H 2 0), -1 (H 2 Pro 2), +2 (DE 2).
Tenga en cuenta que, en general, la molécula es eléctricamente neutra, por lo tanto, en cualquier molécula la suma algebraica de los pasos de oxidación es igual a cero, y en un ion plegado, a la carga del ion.
Por ejemplo, ampliamos la etapa de oxidación del cromo en dicromato de potasio. 2 Cr 2 O 7 .
- La etapa de oxidación es potasio +1, oxidación -2.
- Apreciamos el número de cargas negativas: 7. (-2) = -14
- El número de cargas positivas es + 14. El potasio tiene dos cargas positivas y el cromo tiene 12.
- Entonces como la fórmula tiene dos átomos y cromo, 12 se divide entre dos: 12: 2 = 6.
- + 6 – esta es la etapa de oxidación del cromo.
Verificación: la suma algebraica de las etapas de oxidación positivas y negativas de los elementos es igual a cero, la molécula es eléctricamente neutra.
Robot independiente n.° 1 según la tarjeta de instrucciones: siguiendo las instrucciones, explora las etapas de oxidación de los elementos siguientes: MnO 2, H2SO4, K2SO3, H2S, KMnO4.
¿Qué significan las reacciones oxidativas en términos de la “etapa de oxidación de elementos químicos”? (diapositiva 2)
/ Reacciones de óxido- Se trata de reacciones en las que los procesos de oxidación y renovación ocurren simultáneamente y, por regla general, cambia la etapa de oxidación de los elementos.
Veamos el proceso de interacción entre el zinc y el ácido sulfúrico diluido:
Cuando se clasifica este saldo, se utiliza el método de saldo electrónico. El método se basa en etapas iguales de oxidación de átomos en los compuestos de salida y productos de reacción. La principal ventaja de sumar el saldo mediante este método es que el número de electrones dados puede ser igual al número de electrones recibidos.
- Las reacciones óxido-base son aquellas reacciones que implican la transferencia de electrones de unos átomos, moléculas o iones a otros.
- La oxidación es el proceso de ceder electrones, avanza la etapa de oxidación.
- Renovación: durante el proceso de adquisición de electrones, la etapa de oxidación disminuye.
- Los átomos, moléculas e iones que dan electrones, se oxidan; es decir, día a día.
Los átomos, iones y moléculas que aceptan electrones, se renuevan; є oxidantes. - La oxidación siempre va acompañada de renovación, y la renovación está asociada a la oxidación.
- Reacciones de oxidación-agua: la combinación de dos procesos a largo plazo: oxidación y renovación.
Robot independiente n.° 2 según la tarjeta de instrucciones: utilizando el método de equilibrio electrónico, encuentre y proporcione el coeficiente en el esquema actual de la reacción oxidativa:
MnO 2 + H 2 SO 4 → MnSO 4 + O 2 + H 2 O (2MnO 2 + 2H 2 SO 4 → 2MnSO 4 + O 2 +2H 2 O)
Sin embargo, aprender a encontrar los coeficientes en el OVR no significa sumarlos. Es necesario conocer el comportamiento de los discursos en el OVR, transmitir la reacción, identificar el almacén de productos que se almacenan en la mente de la reacción.
Para entender qué elementos se tratan como oxidantes y cuáles son degenerativos, debemos remontarnos al sistema periódico de D.I. En palabras simples, entonces las autoridades más importantes pueden atribuirse a estos elementos, que tienen un radio atómico mayor que otros y un número pequeño (1-3) de electrones en el nivel de energía actual i. Por eso es que estos pueden provocar fácilmente malos olores. Esto fue importante. Las autoridades modernas más poderosas los utilizan para extraer metales de pradera y tierra de pradera disueltos en los principales subgrupos de los grupos I y II (por ejemplo, sodio, potasio, calcio, etc.).
Los no metales más típicos, que tienen una estructura casi completa de la esfera electrónica externa y tienen un radio atómico significativamente menor que los metales del mismo período, pueden aceptar electrones fácilmente y participan en reacciones de oxidación como el óxido de Yuvachi. Los agentes oxidantes más fuertes son los elementos ligeros de los subgrupos principales VI - VII, como flúor, cloro, bromo, ácido, azufre, etc.
Al mismo tiempo, debemos recordar que dividimos las sustancias simples en materiales oxidantes y oxidantes con la misma claridad con la que las dividimos en metales y no metales. Si no consumen metal, que es un fuerte agente oxidante, todos ellos pueden revelar poderes poderosos. Los elementos en diferentes etapas de oxidación pueden comportarse de manera diferente.
Dado que un elemento se encuentra en un estado de oxidación más alto, puede oxidarse más. Por ejemplo, en HN+5O3 el nitrógeno puede + 5 solo puede oxidarse y aceptar electrones.
Sólo el original puede ser un elemento que se encuentre en el mundo inferior de la oxidación. Por ejemplo, norte-3 norte 3 Entonces el nitrógeno puede -3 puede dar electrones. es un excursionista.
Los elementos en los pasos intermedios de oxidación positiva pueden ceder y aceptar electrones y, por tanto, actuar como agentes oxidantes. Por ejemplo, norte+3, S +4 . Al consumirse en medio de un fuerte agente oxidante, se comportan como margaritas. Y, por cierto, en el medio principal, el hedor tiende a ser oxidante.
Según los poderes oxidativos-primarios, los discursos se pueden dividir en tres grupos:
- oxidantes
- vidnovniki
- oxidantes – oxidantes
Robot independiente nº 3 con mapa instructivo: cada uno de los esquemas de guiado tiene un nivel con la reacción de MnO 2
- 2MnO 2 + O 2 + 4KOH = 2K 2 MnO 4 + 2H 2 O (MnO 2 - diario)
- MnO 2 + 4HCI = MnCI 2 + CI 2 + 2H 2 O (MnO 2 - agente oxidante)
3. Conocimiento perdido y ampliado
Los productos oxidativos y actualizados más importantes.
1. Ácido sircánico – N 2 Entonces 4 є oxidante
A) Relación entre zinc y H diluido 2 SO 4 (diapositiva 3)
¿Qué ion se oxida en esta reacción? (h+ )
El producto se renueva con metal, que se encuentra en un rango de voltaje hasta el agua, є H 2 .
B) Veamos otra reacción: la interacción del zinc con H concentrado. 2 SO 4 (diapositiva 4)
¿Cómo cambian los átomos la etapa de oxidación? (zinc y sirka)
El ácido sulfúrico concentrado (98%) se mezcla con un 2% de agua y se disuelve fácilmente. En realidad, son iones sulfato los que participan en la reacción. El producto de la renovación es sirkvoden.
Depende de la actividad de los productos metálicos del H concentrado renovado. 2 SO 4 diferentes: H2S, S, SO2.
2. Otro ácido, el nítrico, también oxida el nitrato, el ion NO. 3 - . Propiedades oxidativas del nitrato: ion de sustancia importante para el ion H+ El ion agua no se reduce a un átomo, por lo que cuando el ácido nítrico reacciona con los metales, no se ve agua, sino que se crea una mezcla de nitrógeno. Esto depende de la concentración del ácido y de la actividad del metal. El ácido nítrico diluido está más concentrado, menos concentrado (para el mismo metal) (diapositiva 6)
En los diagramas se indican los productos, en lugar de los cuales se muestra la gama máxima de posibles productos ácidos.
El oro y el platino no reaccionan con el HNO 3 , pero estos metales se desintegran en la "tórtola real", una mezcla de ácidos clorhídrico y nítrico concentrados en una mezcla de 3:1.
Au + 3HCI (Conc.) + HNO 3 (Conc.) = AuCI 3 + NO + 2H 2 O
3. El agente oxidante más poderoso entre los compuestos simples es el flúor. Debe estar activo y es importante que se mantenga en buen estado. Por tanto, en laboratorios, cómo oxidar vikoryst.permanganato de potasio KMnO 4 . Sus propiedades oxidativas dependen de la concentración, la temperatura y el medio.
Creación de una situación problemática:Antes de clase, preparé permanganato de potasio (“manganeso”), derramé una botella de vino y arruiné mi bata química favorita. Propón (una vez completadas las pruebas de laboratorio) el discurso que te ayudará a limpiar la bata.
Las reacciones de oxidación-reducción pueden ocurrir en diferentes medios. La naturaleza de la reacción entre estas mismas sustancias también puede cambiar: el fluido intermedio provoca un cambio en las etapas de oxidación de los átomos.
Para crear un medio ácido, agregue ácido sulfúrico. La sal y el nitrógeno deben estancarse antes, porque el primero está listo para oxidarse, y el otro mismo estáfuertemente oxidante y puede provocar procesos secundarios. Para crear una mezcla de pradera, combine hidróxido de potasio o sodio, o agua neutra.
Evidencia de laboratorio:(reglas de tuberculosis)
En varios tubos de ensayo numerados se vierten 1-2 ml de permanganato de potasio diluido. Agregue una gota de ácido sulfúrico al primer tubo de ensayo, agregue agua al tercer tubo de ensayo, hidróxido de potasio al tercer tubo de ensayo, llene el cuarto tubo de ensayo como control. Luego agregue sulfito de sodio a los primeros tres tubos de ensayo, con cuidado. Significar. Cómo cambiar la preparación de la muestra de piel. (Diapositiva 7, 8)
Resultados de laboratorio:
Productos de renovación de KMnO 4 (MnO4-):
- en el medio amargo - Mn+2 (Sil), barvny rozchin;
- en el medio neutral - MnO 2, asedio de tormenta;
- en el prado seredovishche - MnO 4 2- color verde rozchin. (Diapositiva 9)
Antes de los esquemas de reacción:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + KOH → Na 2 SO 4 + K 2 MnO 4 + H 2 O
Seleccione coeficientes para su saldo electrónico adicional. Di oxidación y día (diapositiva 10)
(La tarea es diferente: los científicos fuertes anotan los productos de la reacción por su cuenta)
(diapositiva 11)
Si ha completado las pruebas de laboratorio, complete el discurso que le ayudará a limpiar la bata.
Prueba de demostración:
La solución de permanganato de potasio se puede eliminar fácilmente con una solución de peróxido de agua acidificada con ácido ótico:
2KMnO 4 + 9H 2 O 2 + 6CH 3 COOH = 2Mn(CH 3 COO) 2 + 2CH 3 COCINAR + 7O 2 + 12H 2 O
Cuando usamos permanganato de potasio para reemplazar el óxido de manganeso (IV), sufrimos otra reacción:
MnO 2 + 3H 2 O 2 + 2CH 3 COOH = Mn(CH 3 COO) 2 + 2O 2 + 4H 2 O (diapositiva 12)
Después de quitar las manchas, los trozos de tela se deben enjuagar con agua.
Importancia de las reacciones de óxido.
En una lección es imposible examinar todos los diferentes tipos de reacciones de óxido. Es importante reevaluar su importancia en la química, la tecnología y la vida cotidiana.
Aprender: Las reacciones de óxido son la base de la separación de metales y aleaciones, agua y halógenos, prados y medicamentos.
El funcionamiento de las membranas biológicas y muchos procesos naturales están asociados con reacciones oxidativas: fermentación, fermentación y fotosíntesis. Sin comprender la esencia y los mecanismos de las reacciones oxidativas, es imposible comprender el trabajo de los reactores químicos (acumuladores y baterías), la eliminación de recubrimientos secos y el procesamiento magistral de las superficies metálicas de las partículas.
Para fines de desinfección y desinfección, utilice las propiedades oxidativas de sustancias tan comunes como peróxido de agua, permanganato de potasio, cloro y cloro, o más cloro, especialmente.
El cloro, como fuerte agente oxidante, se utiliza para esterilizar agua limpia y descontaminar aguas residuales.
4. Asegurar el material atornillado
Prueba:
- El medio ácido tiene KMnO 4 actualizado a:
- sal manganeso +2
- MnO2
- K2MnO4
- H concentrado 2 Entonces 4
- HNO concentrado 3 no reacciona con el metal:
- Diluir HNO 3
- N2O
- ¿Cuál es el producto de la renovación del KMnO? Faltan 4: 2KMnO 4 + 3K 2 SO 3 + H 2 O = + 3K 2 SO 4 + 2KOH
- MnO2
- 2MnSO4
- K2MnO4
(verificación mutua de pruebas por parejas)
5. Jardinería casera
Para los esquemas vicorísticos dados en la lección, complete la ecualización de la reacción y distribuya los coeficientes en ellos usando el método del balance electrónico:
- AI + H 2 SO 4 (conc.) →
- Ag + HNO 3 (conc.) →
- KBr + KMnO 4 + H 2 SO 4 → …….. + Br 2 + K 2 SO 4 + H 2 O (diapositiva 13)
6. Presentar bolsas a la lección.
tarjeta instructiva
I. Repetición y fortalecimiento de material previamente aprendido
Zavdannya 1: Ampliar las etapas de oxidación de elementos en las siguientes:
MnO2, H2SO4, K2SO3, H2S, KMnO4.
Zavdannya 2: Utilizando el método del balance electrónico, averigüe y proporcione los coeficientes en el esquema de reacción directa del óxido:
MnO 2 + H 2 SO 4 → MnSO 4 + O 2 + H 2 O
Zavdannya 3: En cualquiera de los esquemas, la reacción de MnO 2 muestra el poder de un oxidante, y éste muestra el poder de un líder:
A) 2MnO 2 + O 2 + 4KOH = 2K 2 MnO 4 + 2H 2 O B) MnO 2 + 4HCI = MnCI 2 + CI 2 + 2H 2 O
II. Pogliblennya y conocimientos ampliados:
Evidencia de laboratorio: (siga las reglas de TB)
En varios tubos de ensayo numerados se vierten 1-2 ml de permanganato de potasio diluido. Agregue una gota de ácido sulfúrico al primer tubo de ensayo, agua al tercero, hidróxido de potasio al tercero y llene el cuarto tubo de ensayo con el control. Luego agregue sulfito de sodio a los primeros tres tubos de ensayo, con cuidado.
Descubra cómo se cambia la preparación de la mezcla en la muestra de piel:
1 tubo de ensayo -
2 tubos -
3 tubos -
4 tubos - control
Zavdannya: Antes de los esquemas de reacción:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + KOH → Na 2 SO 4 + K 2 MnO 4 + H 2 O
Seleccione coeficientes para su saldo electrónico adicional. Digamos oxidación y oxidación.
III. Asegurar el material atornillado
Prueba:
1. El medio ácido es KMnO 4 actualizado a:
A) fuerza Mn +2 B) MnO 2 C) K 2 MnO 4
2. H concentrado 2 Entonces 4 a temperatura inicial es pasivo:
A) Zn B) Cu C) Al
3.HNO concentrado 3 no reacciona con el metal:
A) Ca B) Au C) Mg
4.Diluido con HNO 3 con actualizaciones de metales activos para:
A) NO B) N 2 C) N 2 O
5. ¿Cuál es el producto de la renovación del KMnO? Faltan 4:
2KMnO 4 + 3K 2 SO 3 + H 2 O = + 3K 2 SO 4 + 2KOH
A) MnO 2 B) 2MnSO 4 C) K 2 MnO 4
Puntuación de la prueba (basada en los resultados de la verificación cruzada)
IV. Mejoras para el hogar
Los esquemas vikoristas, presentados en la lección, completan la evaluación de la reacción y la distribución de coeficientes en ellos:
1. AI + H 2 SO 4 (conc.) →
2. Ag + HNO 3 (conc.) →
3. KBr + KMnO 4 + H 2 SO 4 → …….. + Br 2 + K 2 SO 4 + H 2 O
Presentación de la lección (notas de la lección)
Iluminación principal
Línea de material didáctico de O. S. Gabrielyan. Química (8-9)
¡Respeto! La administración del sitio no es responsable de la sustitución de los desarrollos metódicos, así como de la coherencia del desarrollo del Estándar Educativo del Estado Federal.
Literatura de Wikoristan:
- Un libro de referencia para un profesor de química. Octavo grado S.O. Gabrielyan, N.P. Voskoboynikova, A.V. Yashukova (M.: Avutarda). 2003r.
- EFU Química 8vo grado. S.O. Gabrielyan, (M.: Avutarda).
- El trabajador admira al asistente O.S. Gabrielyana Química 8vo grado. S.O. Gabrielyan, A.S. Solodkov (M.: Avutarda-2013).
Objetivos de la lección:
- lo esencial: familiarizarse con la nueva clasificación de reacciones químicas basada en el signo de un cambio en las etapas de oxidación de los elementos: reacciones oxidativas, repetir los conceptos de "oxidante", "oxidante", "oxidación", "en "Actualización";
- desarrollando: continuar el desarrollo del pensamiento lógico, dando forma al interés en un tema, la investigación y las tecnologías modernas.
- vykhovny: formule una cosmovisión científica de los científicos, formule una cultura de colaboración intersocial: evalúe su trabajo.
Zasobi navchannya:
- Programa electrónico para el profesor “Química 8vo grado”. S.O. Gabrielyan, (M.: Avutarda).
- Guía básica interactiva “QUÍMICA VISUAL. Química. 8-9 grados Moscú: LLC "Ispit-Media" 2011-2013
Pidruchnik: EFU Gabrielyan O.S. Química.8º grado: - M.: Avutarda, 2015
Progreso de la lección
1. Etapa organizativa
Preparar a los estudiantes para el trabajo en clase. Reglas para robots y TV en la clase inteligente cuando se trabaja con computadoras portátiles
2. Actualización de conocimientos académicos
A) Todos conocemos la clasificación de las reacciones químicas y los signos que subyacen a la clasificación de la piel. Repetir. "Tipos de reacciones químicas" (especialmente navchannya 2)
Trabajo de literatura 1:
1. Dependiendo del tipo y tipo de discurso que reacciona y se crea, existen reacciones:
una conexión;
b) despliegue;
c) sustitución;
d) intercambio (cirugía y reacción de neutralización).
2. Detrás del tren de agregados, las reacciones (fases) se separan:
a) homogéneo;
b) heterogéneo.
3. Según el efecto térmico, las reacciones se dividen en:
a) exotérmico (reacción inflamable);
b) endotérmico.
4. Se observan las reacciones del catalizador:
a) catalítico (incluido enzimático);
b) no catalítico.
5. Las reacciones se diferencian directamente:
a) hombres lobo;
b) irrevocable.
B) Dé una descripción más detallada de la reacción de síntesis de óxido de azufre (6) con óxido de azufre (4) y ácido:
3. Adquisición de nuevos conocimientos de EFU
A) Zgadaymo, ¿qué es S.O.? Y como cambiar por XP. (Repita con la inversión gradual, especialmente comenzando 2.)

B) Explicación del material de las EFU lado 263–265.


V) Trabajar con el suplemento electrónico EFU.

D) Trabajo de la literatura 2.

4. Conocimiento primario
A) Aprenda a hacer un legado. SUPLEMENTO ELECTRÓNICO

Al torcer el bando vikorista. 264-265 ZEF.
B) El trabajo se basa en el suplemento electrónico, el descubrimiento del oxidante, el oxidante, la transferencia de electrones, el trabajo de la pizarra.
Oleksandrova Anfisa Mijaílivna
Profesor de química
Institución educativa municipal "Escuela secundaria Privolzka" Distrito de Volzky RME
Tema: “Reacciones óxido-óxido”
Tipo de lección: lección - refuerzo y repetición de material procedente del aprendizaje del trabajo frontal, por parejas e individual de los estudiantes.
mira la lección- Explicativo e ilustrativo.
Aplicar métodos y métodos. Verbal-principalmente y demostrativo-práctico. Trabajo independiente desde la búsqueda de la evidencia correcta, discusión del tipo seleccionado, evidencia de laboratorio del nivel escrito actual de reacciones, discusión de los resultados del trabajo.
Objetivo: Podgliblennya conocimiento shodo plegó el método Rivnyan OVR de equilibrio electrónico.
Instrucciones de la lección:
Osvitny: repetir los conceptos básicos sobre los procesos de oxidación y renovación, la etapa de oxidación, oxidación y oxidación, considerar la esencia de las reacciones oxidativas, resumir la formación de reacciones químicas que ocurren en varios medios utilizando el método del equilibrio electrónico.
Desarrollando: aceptar el desarrollo y desarrollo del interés cognitivo de los estudiantes en el tema, aceptar el desarrollo del pensamiento de los estudiantes, analizar la formación y desarrollo del conocimiento sobre el tema.
Vijovni: Desarrollar necesidades informadas de personas conocedoras, escuchar atentamente los pensamientos de cada miembro del equipo.
Reactivos: disuelva permanganato de potasio, ácido sulfúrico, sulfito de sodio, agua.
Equipo: tubos de ensayo, pipetas.
Plan de estudios:
I. Actualización de conocimientos.
V. Tarea.
VI. Reflexión y soporte de bolsas.
Lema de la lección: “Quién quiere gastar, pero quién quiere saber…”
I. Actualización de conocimientos.
Rozmova antes de que se tejiera el material.
1) ¿Qué reacciones se llaman reacciones oxidativas?
Las reacciones oxidativas son reacciones que implican la transferencia de electrones de unos átomos, moléculas e iones a otros.
2) ¿Cuál es el proceso de oxidación?
La oxidación es el proceso de ceder electrones, avanza la etapa de oxidación.
3) ¿Qué proceso se llama renovación?
La renovación es el proceso de ganar electrones y la etapa de oxidación disminuye.
4) ¿Cuáles son los nombres de las partículas que forman los electrones?
Los átomos, moléculas e iones que dan electrones, se oxidan; es decir, día a día.
5) ¿Cómo se llaman las partículas que capturan electrones?
Los átomos, iones y moléculas que aceptan electrones, se renuevan; є oxidantes.
6) ¿Qué es la “etapa de oxidación”?
La etapa de oxidación es la carga mental de un átomo en una molécula, calculada en el sentido de que la molécula está compuesta de iones y generalmente es electroneutra (la carga mental de un átomo, que le atribuimos cuando recibe electrones).
7) ¿Qué método de plegado de reacciones óxido-óxido conoces? ¿Qué regla es la base de esto?
Trabajo independiente de estudiar en la escuela con tarjetas (como se discutió).
1. Son significativas las etapas de valencia y oxidación de los elementos en las siguientes etapas:
CH 4, Cl 2, CO 2, NH 3, C 2 H 4, CH 3 COOH, V 2 O 5, Na 2 B 4 O 7, KClO 4, K 2 HPO 4, Na 2 Cr 2 O 7.
Sugerencia: Para brujería, puedes usar el programa 1.
IV III III III
W -4 norte +1 4 , Cl 0 2, C +4 Pro -2 2, N -3 H +1 3, C -2 2 H +1 4, C -3 H +1 3 C +3 O -2 O -2 H +1, V +5 2 O -2 5 ,
I VII II I I V II I VI II
K +1 Cl +7 O -2 4 , K +1 2 H +1 P +5 O -2 4 Na +1 2 Cr +6 2 O -2 7 .
2. ¿En cuál de las inducciones el nivel más bajo de la reacción de MnO 2 indica el poder del oxidante y en cuál de ellas muestra el poder del oxidante?
A ) 2MnO2 + 2H2SO4 2MnSO4 + O2 + 2H2O;
b ) 2MnO2 + O2 + 4KOH 2K2MnO4 + 2H2O;
V ) MnO 2 + H 2 = MnO + H 2 O;
GRAMO ) 2MnO 2 + 3NaBiO 3 + 6HNO 3 = 2HMnO 4 + 3BiONO 3 + 3NaNO 3 + 2H 2 O
Sujeto:
El oxidante acepta electrones y, como resultado, la etapa de oxidación disminuye, por lo tanto, en el otoño. Aі V El MnO 2 es oxidante. El reactor libera electrones y, como resultado, la etapa de oxidación avanza, por tanto, en las gotas bі GRAMO MnO 2 es el ancestro.
II. Motivación y fijación de objetivos.
Las reacciones de óxido son extremadamente amplias. Asociados a ellos, por ejemplo, están los procesos de metabolismo y metabolismo que ocurren en un organismo vivo, la descomposición y la fermentación, la fotosíntesis. Los procesos de óxido-agua acompañan la circulación de los ríos en la naturaleza. Se pueden evitar durante incendios, durante procesos de corrosión de metales, durante electrólisis y fundición de metales. Ayudarán a eliminar la humedad y los ácidos, así como muchos otros productos valiosos. Las reacciones de óxido son la base de la conversión de energía química en energía eléctrica en celdas galvánicas y de combustión.
Problema: Antes de clase, preparé permanganato de potasio ("manganeso"), derramé una botella de basura y estropeé mi amada bata química. Propongo (después de completar las pruebas de laboratorio) una declaración que pueda usarse para limpiar la bata.
III. Practicar y ampliar conocimientos.
Las reacciones de oxidación-reducción pueden ocurrir en varios medios. La naturaleza de la reacción entre estas mismas sustancias también puede cambiar: el fluido intermedio provoca un cambio en las etapas de oxidación de los átomos.
Para crear un medio ácido, agregue ácido sulfúrico. La sal y el nitrógeno deben estancarse antes, porque El primero es propenso a la oxidación y el otro es altamente oxidante y puede provocar procesos secundarios. Para crear una mezcla de pradera, combine hidróxido de potasio o sodio, o agua neutra.
Evidencia de laboratorio: (reglas de tuberculosis)
En varios tubos de ensayo numerados se vierten 1-2 ml de permanganato de potasio diluido. Agregue una gota de ácido sulfúrico al primer tubo de ensayo, agregue agua al tercer tubo de ensayo, hidróxido de potasio al tercer tubo de ensayo, llene el cuarto tubo de ensayo como control. Luego agregue sulfito de sodio a los primeros tres tubos de ensayo, con cuidado. Tenga en cuenta cómo cambia la preparación en la muestra de piel.
Resultados de laboratorio:
Productos de renovación de KMnO 4 (MnO4-):
para el medio amargo – Mn +2 (sil), sin granero;
en el medio neutral: sedimento de tormenta de MnO 2;
en el medio del prado - MnO 4 2 - color verde.
Zavdannya . Datos del esquema de reacción:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + KOH → K 2 MnO 4 + Na 2 SO 4 + H 2 O
La tarea es diferente: los científicos fuertes anotan los productos de reacción de forma independiente:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 →
KMnO 4 + Na 2 SO 3 + H 2 O →
KMnO 4 + Na 2 SO 3 + KOH →
Seleccione coeficientes utilizando el método del balance electrónico utilizando el algoritmo (Apéndice 1). Digamos oxidación y oxidación.
Sujeto:
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 → 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
2KMnO 4 + 3Na 2 SO 3 + H 2 O → 2MnO 2 ↓ + 3Na 2 SO 4 + 2KOH
2KMnO 4 + Na 2 SO 3 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O
Si ha completado las pruebas de laboratorio, complete el discurso que le ayudará a limpiar la bata.
Los productos de reacción se muestran en los diagramas siguientes. Especifique los reactivos, sume la ecuación de reacción y utilice el método de balanza electrónica:
(aprende a practicar en parejas)
a) KI + KMnO 4 +. . . ->MnSO 4 + I 2 + K 2 SO 4 + H2O
Evidencia: dado que la reacción da como resultado la liberación de Mn +2, el proceso se desarrolla en un medio ácido con la participación de ácido sulfúrico y se forma sulfato de potasio.
10KI + 2 KMnO 4 + 8H 2 SO 4 = 2MnSO 4 + 5I 2 + 6K 2 SO 4 +8H 2 O
2I -1 -2e -> I 2 0 5 - oxidación, oxidación
Mn +7 + 5e -> Mn +2 2- renovación, oxidación
b ) NaI + KMnO 4 + . . . -> Yo 2 + K 2 MnO 4 + NaOH
Evidencia: porque como resultado de la reacción sale K 2 MnO 4 y el proceso avanza en el medio adecuado con la participación de hidróxido de potasio.
2NaI + 2 KMnO 4 + 2KOH = Yo 2 + 2K 2 MnO 4 + 2NaOH
2I -1 -2e -> I 2 0 1- oxidación, día
Mn +7 + 1e -> Mn +6 2- renovación, oxidación
V ). . . + KMnO 4 + H 2 O -> NaNO 3 + MnO 2 + KOH
Evidencia: en esta reacción de oxidación de volúmenes de KMnO 4, es fácil suponer que el nitrito de sodio se convierte en nitrato de sodio, donde N +3 en nitrato:
3 NaNO 2 + 2 KMnO 4 + H 2 O = 3NaNO 3 + 2MnO 2 + 2KOH,
N +3 - 2e -> N +5 3 - oxidación, oxidación
Mn +7 + 3e -> Mn +4 2 - renovación, oxidación
Además del permanganato de potasio, otras palabras pueden tener un efecto oxidativo. Puede obtener más información sobre ellos en el Anexo 2.
1) H2SO4 (diluido), oxidado H+1
El producto está actualizado con metal, que se encuentra en un rango de voltaje hasta el agua - H2.
Por ejemplo,
H 2 SO 4 (integro) + Zn -> ZnSO 4 + H 2
H 2 SO 4 (disuelto) + Cu no reacciona.
2) H 2 SO 4 (concentrado), agente oxidante S +6
Depende de la actividad de los productos metálicos de H concentrado. 2 SO 4 diferentes: H 2 S; S; Entonces 2 . El producto renovador también permanece en la concentración. ácidos (tabla 18 página 250 del manual).
3) Oxidante HNO 3 norte +5 (Tabla 18 página 250 del manual).
HNO concentrado 3 Pasivos como metales como Fe, Cr, Al, lo que se debe a la formación de un óxido fundido fino o muy espeso en la superficie de estos metales.
Au y Pt no reaccionan con HNO 3, pero estos metales se separan en la "tórtola real", una mezcla de ácidos clorhídrico y nítrico concentrados en una proporción de 3: 1.
Por ejemplo:
Au + 3HCl (Conc.) + HNO 3 (Conc.) = AuCl 3 + NO + 2H 2 O.
4) Hasta 2 C r 2 O 7 en medio ácido se renueva a Cr 3+
en medio neutro hasta Cr 2 O 3
en el prado seredovishche hasta CrO 4 2-
Las reacciones de óxido en química orgánica están asociadas con la formación de enlaces ácidos o con la separación de agua.
Regla para realizar conexiones: - ВІН → -1е
Pro → -2е
división de 1 átomo H → -1е
I V. Consolidación del material investigado.
Para consolidar el material cubierto, paso las pruebas.
Opción 1
1. ¿Qué no metal es un oxidante fuerte?
1) flúor 2) sirka 3) ozono 4) silicio
2. La etapa de oxidación ácida del sulfato de potasio es más antigua.
1)+6 2)+4 3)0 4)-2
3. En cualquier reacción, el átomo de cloro desempeña el papel de padre.
1) Cu + Cl 2 = CuCl 2
2) HCl + NaOH = NaCl + H2O
3) HCl + MnO 2 = MnCl 2 + Cl 2 + H 2 O
4) Cl 2 + H 2 = HCl
5) +2 → 0
6) 0 → - 1
5. Método vikorista de balanza electrónica para igualar reacciones:
PbS + H 2 O 2 →PbSO 4 + H 2 O
6. El método vikorista de balanza electrónica iguala la reacción:
KBr + KMnO 4 + H 2 SO 4 → …….. + Br 2 + K 2 SO 4 + H 2 O
Viznachte okislyuvach ta vidnovnik.
Tipo: 1-1; 2-1; 3-3; 4-A3, B4, B2, G5.
opcion 2
1. En cualquier solución que haya reaccionado exageradamente, el átomo de azufre está en la etapa de oxidación +6
1) FeSO 3 2) S 3) SO 2 4) Hasta 2 SO 4
2. ¿Qué elemento se renueva en la reacción Fe2O3+CO=Fe+СО2?
1) zalizo 2) kisen 3) carbón
3. Seleccione el nivel de reacción en el que se oxida el elemento carbono.
1)2C + O2 = 2CO
2) CO 2 + 2 Mg = 2 MgO + C
3) CH 4 + 2O 2 = CO 2 + 2H 2 O
4) C + 2H 2 SO 4 = CO 2 + 2H 2 O + 2SO 2
4. Establezca la consistencia entre las reacciones y cambie la etapa de oxidación del oxidante en esta reacción:
Reacción comparativa Cambio de la etapa de oxidación del oxidante.
A) S O 2 + NO 2 = S O 3 +NO 1) -1 → 0
B) 2NH 3 + 2Na = 2NaNH 2 + H 2 2) 0 → -2
B) 4NO 2 + O 2 + 2H 2 O = 4HNO 3 3) +4 → +2
D) 4NH 3 + 6NO = 5N 2 + 6H 2 Pro 4) +1 → 0
5) +2 → 0
6) 0 → - 1
5. Método vikorista de balanza electrónica, sume la reacción:
NaNO 2 + NH 4 Cl → NaCl + 2H 2 O + N 2
Viznachte okislyuvach ta vidnovnik.
6. Método Vikoryst de balanza electrónica, sume la reacción:
KI+H 2 ENTONCES 4 +NaNO 2 → …… + K 2 ENTONCES 4 +Na 2 ENTONCES 4 + NO + H 2 oh
Viznachte okislyuvach ta vidnovnik.
Tipo: 1-4; 2-1; 3-2; 4-A3, B4, B2, G5.
V. Tarea.
1. Sume la reacción igual y la distribución de coeficientes para el otro método de balanza electrónica:
1. K 2 Cr 2 O 7 + KNO 2 + …….→ KNO 3 + Cr 2 (SO 4 ) 3 + …..+H 2 O
2. C 6 H 5 -CH 3 + KMnO 4 + H 2 SO 4 → C 6 H 5 COOH +….+….+…..
3. 3 2 H 5 OH + K 2 Cr 2 O 7 + H 2 SO 4 → CH 3 COOH +….+….+…..
4.Na 2 SO 3 + Hasta 2 Cr 2 O 7 + H 2 SO 4 → ….+….+….+…..
2. Combine la oxidación del formaldehído con permanganato de potasio, acidificado con ácido sulfúrico para que el formaldehído se oxide a coeficientes de CO 2, seleccione el método de balance electrónico. 2
juntos, llamen al viejo - 2, crema H 2 O 2 -1 y ОF 2.
4. Etapa de oxidación del átomo de agua en
en conexión entre sí, llame al anterior +1, crema MeH (hidruros).
5. Suma algebraica de pasos de oxidación.
los elementos de los conexos son iguales a 0.
etapa de oxidación
Poder de discursos a base de óxido.
Tipos de reacciones de oxidación-renovación.
Reacciones directas óxido-óxido.
Las reacciones oxidativas incluyen aquellas que van acompañadas del movimiento de electrones de una partícula a otra. Al observar los patrones de reacciones oxidativas-nuevas, el concepto de etapa de oxidación queda claro.
1. Etapa de oxidación
Concepto etapa de oxidación introducido para caracterizar el estado de los elementos en las conexiones. Por etapa de oxidación se entiende la carga mental de un átomo en el subsuelo, cálculos que parten del supuesto de que la concatenación está formada por iones. La etapa de oxidación se indica con un número arábigo con un signo más cuando los electrones se desplazan de un átomo dado a otro átomo y con un número con un signo menos cuando los electrones se desplazan de la dirección de retorno. Coloque el número з con un signo “+” o “-” encima del símbolo del elemento. La etapa de oxidación indica el estado de oxidación del átomo y es una forma sencilla de transferencia de electrones: no queda rastro de la carga efectiva del átomo en la molécula (por ejemplo, en la molécula de LiF las cargas efectivas de Li y F son iguales a Uniforme + 0,89 y -0,89 , entonces la etapa de oxidación es +1 y -1), no la valencia del elemento (por ejemplo, en los compuestos CH 4, CH 3 OH, HCOOH, CO 2, la valencia de El carbono es 4 y la etapa de oxidación es similar a -4, -2, +2, +4). Los valores numéricos de la etapa de valencia y oxidación se pueden reducir en valor absoluto incluso cuando se crea la estructura iónica.
Cuando se selecciona la etapa de oxidación, se aplican las siguientes reglas:
Los átomos de elementos que se encuentran en la naturaleza o en forma de moléculas de sustancias simples tienen una etapa de oxidación igual a cero, por ejemplo Fe, Cu, H 2, N 2, etc.
La etapa de oxidación del elemento en forma de ion monoatómico en la subunidad, que forma un ion bodov, es similar a la carga de este ion,
1 -1 +2 -2 +3 -1
por ejemplo, NaCl, Cu S, AlF 3.
La mayor parte del agua tiene una etapa de oxidación de +1, seguida de los hidruros metálicos (NaH, LiH), que tienen una etapa de oxidación de -1.
La etapa más amplia de oxidación ácida es -2, después de los peróxidos (Na 2 O 2, H 2 O 2), en los que la etapa de oxidación ácida es -1 y F 2 O, en la que la etapa de oxidación ácida es +2 .
Para elementos con etapa de oxidación inestable, sus valores se pueden descomponer conociendo la fórmula de combinación, de modo que la suma algebraica de las etapas de oxidación de todos los elementos en una molécula neutra sea igual a cero. En un ion plegable, esta cantidad es igual a la carga del ion. Por ejemplo, la etapa de oxidación del átomo de cloro en la molécula de HClO 4 se calcula a partir de la carga total de la molécula = 0, donde x es la etapa de oxidación del átomo de cloro) y +7. La etapa de oxidación del átomo de azufre en el ion (SO 4) es 2-[x + 4(-2) = -2] +6.
2. Poder de los discursos a base de óxido.
Cualquier reacción oxidativa consta de procesos de oxidación y renovación. Oxidación - Este es el proceso de ceder electrones por parte de un átomo, ion o molécula a un reactivo. Di lo que dicen sus electrones se oxidan durante el proceso de reacción. vidnovnikami.
La renovación es el proceso de aceptación de electrones por parte de un átomo, reactivo iónico o molecular.
Los discursos que aceptan electrones y así se regeneran se llaman oxidantes.
Las reacciones de oxidación-renovación siempre ocurren como un solo proceso llamado reacción de óxido. Por ejemplo, durante la interacción del zinc metálico con iones de cobre. diario(Zn) cede sus electrones oxidar– iones de cobre (Cu 2+):
Zn + Cu 2+ Zn 2+ + Cu
El cobre es visible en la superficie del zinc y se transfiere al zinc en los bordes.
Los poderes oxidativos relativos de los elementos están asociados con la vida de sus átomos y están determinados por las disposiciones del sistema periódico D.I. Mendelev. La singularidad del elemento se debe al enlace débil de los electrones de valencia del núcleo. Los átomos de los metales, para alcanzar el nivel de energía actual, tienen un pequeño número de electrones similar a su salida. se oxidan fácilmente y desempeñan el papel de oxidantes. Los metales más poderosos son los metales más activos.
El criterio para la actividad oxidativa de los elementos puede ser su valor. electronegatividad obvia: cuanto más alto es, más fuertemente se expresa la actividad oxidativa del elemento, y cuanto más bajo es, más claramente se manifiesta su actividad oxidativa. Los átomos de los no metales (por ejemplo, F, O) tienen un alto valor de densidad electrónica y una alta electronegatividad, por lo que aceptan electrones fácilmente. є oxidantes.
El poder a base de óxido del elemento radica en la etapa de su oxidación. El mismo elemento está separado. etapas de oxidación inferior, superior e intermedia.
Como un trasero, veamos el sirku S y її її їлуки H 2 S, SO 2 y SO 3. La conexión entre la estructura electrónica del átomo de azufre y sus poderes primarios oxidativos en estos casos se basa en las representaciones científicas de la Tabla 3.1.
En la molécula de H 2 S, el átomo de azufre tiene una configuración de octeto estable del nivel de energía externo 3s 2 3p 6 y, por lo tanto, ya no puede aceptar electrones o regalarlos.
El estado del átomo del cual se pueden aceptar la mayor cantidad de electrones se llama etapa de oxidación más baja.
En el nivel más bajo de oxidación, el átomo pierde sus propiedades oxidativas y puede convertirse sólo en una fuente.
Tabla 1.
|
Fórmula del habla |
fórmula electrónica |
Autoridades a base de óxido |
|
|
|
1s 2 2s 2 2p 6 3s 2 3p 6 |
|
|
|
|
1s 2 2s 2 2p 6 3s 2 3p 4 |
oxidante |
diario |
|
|
1s 2 2s 2 2p 6 3s 2 3p o |
oxidante |
|
|
|
1s 2 2s 2 2p 6 3s o 3p 0 |
oxidante |
|
En la molécula de SO 3, todos los electrones externos del átomo de Sir se desplazan a átomos ácidos. Entonces, en este caso, el átomo de azufre puede adquirir electrones, exhibiendo poder oxidativo.
El estado del átomo en el que ha perdido todos los electrones de valencia se denomina etapa de oxidación superior. Un átomo que se encuentra en la etapa más alta de oxidación puede estar menos oxidado.
En una molécula de SO 2 y un azufre elemental S, el átomo de azufre se encuentra en etapas intermedias de oxidación, entonces, al tener electrones de valencia, el átomo puede regalarlos, pero sin completarse R - Suscriptor, podrás recibir correos electrónicos hasta su finalización.
El átomo del elemento que se encuentra en la etapa intermedia de oxidación se puede identificar tanto como poder oxidante como oxidativo, lo que se indica por su papel en una reacción específica.
Entonces, por ejemplo, el papel del sulfito - SO anión  las siguientes reacciones varían:
las siguientes reacciones varían:
5Na 2 SO 3 + 2KMnO 4 + 3H 2 SO 4 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O (1)
H 2 SO 3 + 2 H 2 S 3 S + 3 H 2 O (2)
En la reacción (1) anión sulfito SO  en presencia de un agente oxidante fuerte, el KMnO 4 desempeña el papel de eliminador; en la reacción (2) anión sulfito SO
en presencia de un agente oxidante fuerte, el KMnO 4 desempeña el papel de eliminador; en la reacción (2) anión sulfito SO  - agente oxidante, los fragmentos de H 2 S pueden presentar una pérdida de potencia.
- agente oxidante, los fragmentos de H 2 S pueden presentar una pérdida de potencia.
De esta manera, entre discursos plegados vidnovnikami puedo peroi:
1. Palabras simples, cuyos átomos contienen valores bajos de energía de ionización y electronegatividad (zocrema, metal).
2. Palabras compuestas que destruirán átomos en las etapas inferiores de oxidación:
h CL,H2 S,norte H 3
Na 2 S O3, fe Cl2, sn(N° 3) 2 .
Okislyuvachami puedo peroi:
1. Palabras simples, cuyos átomos tienen valores altos de densidad electrónica y electronegatividad: no metales.
2. Discursos plegables que se vengan de los átomos en niveles más altos de oxidación: +7 +6 +7
k Minnesota O 4 , K 2 cr 2O7, HClO4.
3. Palabras compuestas que reemplazan átomos en las etapas intermedias de oxidación:
Na 2 S O3, Minnesota O2, Minnesota SO4.
- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0

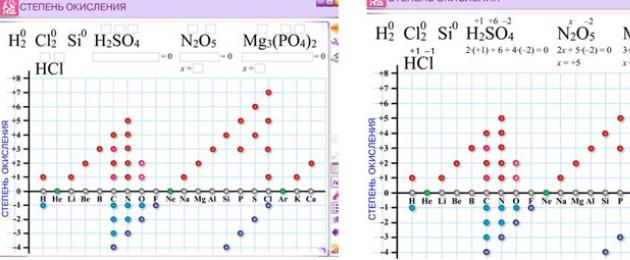


 –2
–2

 ;
;
 - 6
- 6

 ;
;
 - 8
- 8

 diario
diario

 +
2
+
2


 –4
–4

 ;
; -
6
-
6




 +
4
+
4 

 ;
; +
6
+
6


 -2
-2

 diario
diario

 +
2
+
2

 ;
;
 + 6
+ 6

 ;
; +
8
+
8