2 Урок хімії в 8-му класі на тему «Окислювально-відновлювальні реакції»
Анотація:Урок хімії на тему «Окислювально-в позитивні реакції» призначений для учнів 8-х класів. На уроці розкриваються основні поняття про окислювально-відновні реакції: ступінь окислення, окислювач, відновник, окислення, відновлення: формується вміння складати записи ОВР методом електронного балансу.
Урок хімії у 8-му класі на тему
«Окислювально-в позитивні реакції»
МЕТА УРОКУ:формувати систему знань про окислювально-відновні реакції, навчити складати записи ОВР методом електронного балансу.
ЗАВДАННЯ УРОКУ:
Навчальні: розглянути сутність окислювально-відновних процесів, навчити застосовувати «ступеня окислення» для визначення процесів окислення та відновлення; навчити учнів зрівнювати записи окислювально-відновної реакції методом електронного балансу.
Розвиваючі: удосконалювати вміння висловлювати судження про тип хімічної реакції, аналізуючи ступінь окислення атомів у речовинах; робити висновки, працювати з алгоритмами, формувати інтерес до предмета.
Виховують: формувати потребу в пізнавальній діяльності та ціннісне ставлення до знань; аналізувати відповіді товаришів, прогнозувати результати роботи, оцінювати свою роботу; виховати культуру спілкування через роботу у парах «учень – учень», «вчитель – учень».
Тип уроку:Урок вивчення нового матеріалу.
Методи, що використовуються на уроці:Пояснювально-мул люстративний.
Поняття, що вводяться на уроці:окислювально-відновні реакції; окислювач; відновник; процес окиснення; процес відновлення.
Використовуване обладнаннята реактиви:таблиця розчинності, періодична система Д. І. Менделєєва, соляна кислота, сірчана кислота, цинк у гранулах, магнієва стружка, розчин сульфату міді, залізний цвях.
Форма роботи:індивідуальне, фронтальне.
Час уроку: (90 хвилин, 2 уроки).
Хід уроку
I . Організаційний момент
II . Повторення пройденого матеріалу
ВЧИТЕЛЬ:Діти, давайте згадаємо з вами раніше вивчений матеріал про ступінь окислення, який буде необхідний нам на уроці.
Усне фронтальне опитування:
Що таке електронегативність?
Що таке ступінь окиснення?
Чи може ступінь окислення елемента дорівнювати нулю? В яких випадках?
Який ступінь окислення найчастіше виявляє кисень у сполуках?
Згадайте винятки.
Який ступінь окислення виявляють метали в полярних та іонних сполуках?
Як розраховується ступінь окислення за формулами сполук?
Ступінь окиснення кисню майже завжди дорівнює -2.
Ступінь окислення водню майже завжди дорівнює +1.
Ступінь окислення металів завжди позитивна і в максимальному значенні майже завжди дорівнює номеру групи.
Ступінь окислення вільних атомів та атомів у простих речовинах завжди дорівнює 0.
Сумарний ступінь окислення атомів всіх елементів у поєднанні дорівнює 0.
ВЧИТЕЛЬпропонує учням для закріплення сформульованих правил порахувати - знайти ступінь окислення елементів у простих речовинах та сполуках:
S , Н 2 , H 3 PO 4 , NaHSO 3, HNO 3 Cu (NO 2 ) 2, NO 2 Ва, Al.
Наприклад: Яким буде ступінь окислення сірки в сірчаній кислоті?
У молекулах алгебраїчна сума ступенів окислення елементів з урахуванням їх числа атомів дорівнює 0.
H 2 +1 S x O 4 -2
(+1) * 2 + X * 1 + (-2) . 4 = 0
X = + 6
H 2 +1 S +6 O 4 -2
III . Вивчення нового матеріалу
ВЧИТЕЛЬ:Різноманітність класифікацій хімічних реакцій за різними ознаками (напрямку, числу та складу реагуючих та утворюючих речовин, використанню каталізатора, тепловому ефекту) можна доповнити ще однією ознакою. Це ознака – зміна ступеня окиснення атомів хімічних елементів, що утворюють речовини, що реагують.
За цією ознакою розрізняють реакції
Хімічні реакції
Реакції, що протікають із зміною реакції, що протікають без зміни ступеня окиснення елементів ступеня окиснення елементів
Наприклад, у реакції
1 +5 -2 +1 -1 +1 -1 +1 +5 -2
AgNO 3 + HCl AgCl + HNO 3 (біля дошки пише учень)
Ступені окиснення атомів хімічних елементів після реакції не змінилися. А ось в іншій реакції - взаємодія соляної кислоти з цинком
2HCl + Zn ZnCl 2 + H 2 (біля дошки пише учень)
атоми двох елементів, водню та цинку, змінили свої ступені окислення: водень з +1 на 0, а цинк – з 0 на +2. Отже, у цій реакції кожен атом водню отримав по одному електрону
2H + 2e H 2
а кожен атом цинку – віддав два електрони
Zn - 2е Zn
ВЧИТЕЛЬ:Які типи хімічних реакцій ви знаєте?
УЧАТЬСЯ:До ОВР відносяться всі реакції заміщення, а також ті реакції з'єднання та розкладання, в яких бере участь хоча б одна проста речовина.
ВЧИТЕЛЬ:Дати визначення ОВР.
Хімічні реакції, в результаті яких відбувається зміна ступенів окислення атомів хімічних елементів або іонів, що утворюють речовини, що реагують, називають окислювально – відновними реакціями.
ВЧИТЕЛЬ:Діти, визначте усно, яка із запропонованих реакцій окислювально-ос позитивною не є:
1) 2Na + Cl 2 = 2NaCl
2) Na СL + AgNO 3 = NaNO 3 +AgCl↓
3) Zn + 2HCl = ZnCl 2 + H 2
4) S + O 2 = SO 2
УЧНІ:виконують завдання
ВЧИТЕЛЬ:Як приклади ОВР продемонструємо наступний досвід.
H 2 SO 4 + Mg MgSO 4 + H 2
Позначимо ступінь окислення всіх елементів у формулах речовин – реагентів та продуктів цієї реакції:
Як видно з рівняння реакції, атоми двох елементів магнію та водню змінили свої ступені окислення.
Що з ними сталося?
Магній з нейтрального атома перетворився на умовний іон у ступені окислення +2, тобто віддав 2е:
Mg 0 - 2е Mg +2
Запишіть у свій конспект:
Елементи або речовини, що віддають електрони називаються відновниками;в ході реакції вони окислюються.
Умовний іон Н у ступені окислення +1 перетворився на нейтральний атом, тобто кожен атом водню отримав по одному електрону.
2Н +1 +2е Н 2
Елементи або речовини, що приймають електрони, називаються окислювачами; в ході реакції вони відновлюються я.<Приложение 1>
Ці процеси можна подати у вигляді схеми:
Соляна кислота + магній сульфат магнію + водень
CuSO 4 + Fe (залізний цвях) = Fe SO 4 + Cu (красивий червоний цвях)
Fe 0 – 2 еFe +2
Cu +2 +2 еCu 0
Процес віддачі електронів називається окисленням, а прийняття – відновленням.
У процесі окиснення ступінь окиснення підвищується, у процесі відновлення – знижується.
Ці процеси нерозривно пов'язані між собою.
ВЧИТЕЛЬ:Давайте виконаємо завдання за описаним вище зразком.
Завдання:Для окисно-відновних реакцій вкажіть окислювач і відновник, процеси окислення та відновлення, складіть електронні рівняння:
1) BaO + SO 2 =BaSO 3
2) CuCl 2 + Fe = FeCl 2 + Cu
3) Li + O 2 = Li 2 O 3
4) CuSO 4 + 2KOH = Cu(OH) 2 ↓ + K 2 SO 4
II частина уроку (2-й урок)
Метод електронного балансу як спосіб складання рівнянь ОВР
Далі розглянемо складання рівнянь окислювально-відновних реакцій методом електронного балансу. В основі методу електронного балансу лежить правило: загальна кількість електронів, які віддає відновник, завжди дорівнює загальній кількості електронів, які приєднує окислювач.
Після пояснення учні під керівництвом вчителя становлять рівняння ОВР за планами, що їх склав вчитель до цього уроку <Приложение 2>.
Пам'ятки перебувають у кожного учня на парті.
ВЧИТЕЛЬ:Серед вивчених нами реакцій до окисно-відновних реакцій відносяться:
Взаємодія металів з неметалами
2Mg + O 2 = 2MgO
Окислювач O 2 +4e 2O -2 1 відновлення
2. Взаємодія металів із кислотою.
H 2 SO 4 + Mg = MgSO 4 +H 2
Відновник Mg 0 -2e Mg +2 2 окислення
Окислювач 2O -2 +4e O 2 0 1 відновлення
3. Взаємодія металів із сіллю.
Cu SO 4 + Mg = MgSO 4 + Cu
Відновник Mg 0 -2e Mg +2 2 окислення
Окислювач Cu +2 +2e Cu 0 1 відновлення
Диктується реакція, один учень самостійно складає схему реакції біля дошки:
H 2 + O 2 → H 2 O
Визначимо, атоми яких елементів змінюють ступінь окиснення.
(H 2 ° + O 2 ° → H 2 O 2).
Складемо електронні рівняння процесів окислення та відновлення.
(H 2 ° -2e → 2H + - процес окислення,
O 2 ° +4e → 2O - ² - процес відновлення,
Н 2 - відновник, Про 2 - окислювач)
Підберемо загальне ділене для відданих та прийнятих е та коефіцієнти для електронних рівнянь.
(∙2| Н 2 °-2е → 2Н + - процес окислення, елемент – відновник;
∙1| O 2 ° +4e → 2O - ² – процес відновлення, елемент – окислювач).
Перенесемо ці коефіцієнти на рівняння ОВР і підберемо коефіцієнти перед формулами інших речовин.
2 H 2 + O 2 → 2 H 2 O .
IV . Закріплення вивченого матеріалу
Вправи для закріплення матеріалу:
Яка схема перетворення азоту відповідає даному рівнянню реакції
4NH 3 +5O 2 → 4NO + 6H 2 O
1) N +3 → N +2 3) N +3 → N -3
2) N-3 → N-2 4) N-3 → N+2
2) Встановіть відповідність між зміною ступеня окиснення атома сіркита схемою перетворення речовини. Запишіть цифри без пробілів і ком.
СХЕМА ПЕРЕТВОРЕНЬ
A) H 2 S + O 2 → SO 2 + H 2 O
Б) H 2 SO 4 + Na → Na 2 SO 4 + H 2 S + H 2 O
В) SO 2 + Br 2 + H 2 O → H 2 SO 4 + HBr
ЗМІНА СТУПЕНЯ ОКИСЛЕННЯ
1) Е+4 → Е+6
2) Е+6 → Е-2
3) Е+6 → Е+4
4) Е-2 → Е+6
5) Е -2 → Е +4 відповідь (521)
3)Встановіть відповідність між схемою перетворення та зміною ступеня окислення окислювачау ній.
СХЕМА ПЕРЕТВОРЕНЬ
A) Cl 2 + K 2 MnO 4 → KMnO 4 + KCl
Б) NH 4 Cl + KNO 3 → KCl + N 2 O + H 2 O
В) HI + FeCl 3 → FeCl 2 + HCl + I 2
ЗМІНА СТУПЕНЯ
ОКИСЛЕННЯ ОКИСНИКА
1) Е+6 → Е+7
2) Е+5 → Е+1
3) Е+3 → Е+2
4) Е 0 → Е-1
5) Е -1 → Е 0 відповідь (423)
V. Заключне слово вчителя
Окислювально-відновні реакції являють собою єдність двох протилежних процесів: окислення та відновлення. У цих реакціях число електронів, що віддаються відновниками, дорівнює числу електронів, що приєднуються окислювачами. Весь навколишній світ можна розглядати як гігантську хімічну лабораторію, в якій щомиті протікають хімічні реакції, в основному окислювально-відновні.
VI . Рефлексія.
VIII . Домашнє завдання:§ 43, упр.1, 3, 7 стор.234-235.
Використовувана література:
Ступінь окиснення простих речовин дорівнює 0;
Ступінь окислення металів у з'єднаннях дорівнює
1. Габрієлян О.С. “Хімія. 8 клас: навч. для загальноосвіт. установ. -М. : Дрофа, 2010.
Окисно-відновні реакції. Хомченко Г.П., Севастьянова К.І. - З-во Просвітництво, 1985.
ПАМ'ЯТКА ДЛЯ УЧНІВ
Додаток №1
Найважливіші відновники та окислювачі
|
Відновлювачі |
Окислювачі |
|
|
Метали, Н 2, вугілля, СО – оксид вуглецю (II) H 2 S, SO 2 , H 2 SO 3 єосолі HJ, HBr, HCl SnCl 2 ,FeSO 4 ,MnSO 4 , Cr 2 (SO 4 ) 3 HNO 2 - азотиста кислота NH 3 – аміак NO - оксид азоту (II) Альдегіди, спирти, мурашина та щавлева кислоти, Катод при електролізі |
Галогени KMnO 4 , K 2 MnO 4 , MnO 2 , K 2 Cr 2 O 7 , K 2 CrO 4 HNO 3 -азотна кислота H 2 O 2 – пероксид водню Про 3 – озон, Про 2 H 2 SO 4 (конц.), H 2 S еO 4 CuO, Ag 2 O, PbO 2 Іони благородних металів (Ag + , Au 3+) FeCl 3 Гіпохлорити, хлорати та перхлорати «Царська горілка» Анод при електролізі |
|
Додаток №2
Алгоритм складання хімічних рівнянь методом електронного балансу:
1.Скласти схему реакції.
2.Визначити ступеня окислення елементів у реагентах та продуктах реакції.
Пам'ятайте!
номеру групи цих металів (дляI - III групи).
Ступінь окислення атома кисню в
з'єднаннях зазвичай дорівнює - 2, крім H 2 O 2 -1 та ОF 2.
Ступінь окислення атома водню в
з'єднаннях зазвичай дорівнює +1, крімМеH (гідриди).
Алгебраїчна сума ступенів окиснення
елементів у з'єднаннях дорівнює 0.
3.Визначити, чи є реакція окислювально-відновної або вона протікає без зміни ступенів окислення елементів.
4.Подчеркнуть елементи, ступеня окислення яких змінюються.
5.Скласти електронні рівняння процесів окислення та відновлення.
6.Визначити, який елемент окислюється (його ступінь окислення підвищується) і який елемент відновлюється (його ступінь окислення знижується) у процесі реакції.
7.У лівій частині схеми позначити за допомогою стрілок процес окислення (зміщення електронів від атома елемента) та процес відновлення (зміщення електронів до атома елемента)
8.Визначити відновник та окислювач.
9. Збалансувати число електронів між окислювачем та відновником.
10.Визначити коефіцієнти для окислювача та відновника, продуктів окислення та відновлення.
11. Записати коефіцієнт перед формулою речовини, що визначає середовище розчину.
12. Перевірити рівняння реакції.
Додаток 3
Самостійна робота для перевірки знань
Варіант 1
1. Проставте ступінь окислення елементів у сполуках, формули яких IBr, TeCl 4 , SeF e , NF 3 , CS 2 .
2. У наступних схемах реакцій вкажіть ступінь окислення кожного елемента та розставте коефіцієнти методом електронного балансу:
1) F 2 + Хе → XeF 6 3) Na + Br 2 → NaBr
2) S + H 2 → H 2 S 4) N 2 + Mg → Mg 3 N 2
Варіант 2
1.Проставте ступінь окислення елементів у сполуках: H 2 S О 4 , HCN , HN О 2 , РС1 3
2. Допишіть рівняння реакцій окислення-відновлення:
1) CI 2 + Fe → 2) F 2 + I 2 → 3) Ca + З → 4) З + H 2 →
Вкажіть ступінь окислення елементів в отриманих продуктах.
Варіант 3
1. Проставте ступінь окислення у сполуках, формули яких XeF 4 , CC 1 4 , РС1 б, SnS 2 .
2. Напишіть рівняння реакцій: а) розчинення магнію у розчині сірчаної кислоти; б) взаємодії розчину броміду натрію із хлором. Який елемент окислюється і який відновлюється?
Варіант 4
1. Складіть формули наступних сполук: а) нітриду літію (сполуки літію з азотом); б) сульфіду алюмінію (сполуки алюмінію із сіркою); в) фториду фосфору, в яких електропозитивний елемент виявляє максимальний ступінь окислення.
2. Напишіть рівняння реакцій: а) йодиду магнію з бромом; б) розчинення магнію у розчині бромоводневої кислоти. Вкажіть, що у кожному випадку є окислювачем і що – відновником.
Варіант 5
1.Складіть формули наступних сполук: а) фтору з ксеноном; б) берилію з вуглецем, в яких електропозитивний елемент виявляє максимальний ступінь окислення.
2. Розставте коефіцієнти методом електронного балансу у таких схемах:
1) KI + Cu(NПро 3 ) 2 → CuI + I 2 + KNПро 3
2) MnS+HNПро 3 ( кінець .) → MnSПро 4 + NПро 2 + H 2 Про
Варіант 6
1. Проставте ступені окислення кожного елемента в сполуках, формули яких Na 2 S О 3 , КСЮ 3 , NaCIO , Na 2 Cr О 4 ,N Н 4 СlO 4 , BaMn О 4 .
2. Напишіть рівняння реакцій: а) іодиду літію із хлором; б) літію із соляною кислотою. Проставте ступінь окислення всіх елементів та коефіцієнти за методом електронного балансу.
Варіант 7
1. Обчисліть ступені окислення марганцю, хрому та азоту в сполуках, формули яких КMnO 4 , Na 2 Cr 2 Про 7 , NH 4 N Про 3 .
2. Проставте ступеня окислення кожного елемента та розставте коефіцієнти, використовуючи метод електронного балансу в наступних схемах:
2) H 2 S Про 3 + I 2 + H 2 Про → H 2 S Про 4 + HI
Варіант 8
1. Який ступінь окислення вуглецю в оксиді вуглецю (IV) і чи змінюється
Окислювально-відновні реакції належать до найбільш поширених хімічних реакцій і мають велике значення в теорії та практиці. Найважливіші процеси планети пов'язані з цим типом хімічних реакцій. Людство давно користувалося ОВР, спочатку не розуміючи їхньої сутності. Лише на початку XX століття було створено електронну теорію окислювально – відновлювальних процесів. На уроці слід згадати основні тези цієї теорії, метод електронного балансу, навчитися складати рівняння хімічних реакцій, які у розчинах, і з'ясувати чого залежить механізм таких реакцій.
Завантажити:
Попередній перегляд:
МУНІЦИПАЛЬНЕ ЗАГАЛЬНООСВІТНЯ УСТАНОВА
МУНІЦИПАЛЬНА СЕРЕДНЯ ШКОЛА №5 м. Пить-Ях
Урок на тему:
Окисно-відновні реакції.
учитель хімії: Кисакова Ольга Олександрівна
Муніципального навчального закладу
середня загальноосвітня школа № 5,
м. Пить-Ях, 2010
Тема уроку: Окисно-відновні реакції.
Мета уроку: Узагальнити, систематизувати та розширити знання учнів про окисно-відновні реакції, найважливіші окислювачі та продукти їх відновлення.
Завдання:
- Закріпити вміння визначати ступеня окислення елементів, окислювач та відновник, розставляти коефіцієнти методом електронного балансу.
- Удосконалювати вміння визначати окисно-відновні властивості речовин, прогнозувати продукти реакцій залежно від активності металів, концентрації кислот та реакції середовища розчину.
- Виробити вміння складати рівняння хімічних реакцій, які у різних середовищах з прикладу сполук марганцю.
- Показати різноманітність та значення ОВР у природі та повсякденному житті.
- Продовжити підготовку до ЄДІ з хімії.
Хід уроку
1. Організаційний момент
Добридень! Гарного вам настрою!
Тема нашого уроку: «Окислювально – відновлювальні реакції» (Презентація. слайд 1)
Окислювально-відновні реакції належать до найбільш поширених хімічних реакцій і мають велике значення в теорії та практиці. Найважливіші процеси планети пов'язані з цим типом хімічних реакцій. Людство давно користувалося ОВР, спочатку не розуміючи їхньої сутності. Лише на початку XX століття було створено електронну теорію окислювально - відновлювальних процесів. На уроці слід згадати основні тези цієї теорії, метод електронного балансу, навчитися складати рівняння хімічних реакцій, які у розчинах, і з'ясувати чого залежить механізм таких реакцій.
2. Повторення та спілкування вивченого раніше матеріалу
Вам тема ОВР не нова, вона проходить червоною ниткою через весь курс хімії. Тому пропоную повторити деякі поняття та вміння на цю тему.
Перше питання: "Що таке ступінь окислення?". Без цього поняття та вміння розставляти ступені окислення хімічних елементів неможливо розгляд цієї теми.
/ Ступінь окислення- це умовний заряд атома хімічного елемента у поєднанні, обчислений на основі припущення, що всі сполуки складаються лише з іонів. Ступінь окислення може бути позитивним, негативним або дорівнювати нулю, що залежить від природи відповідних сполук.
Одні елементи мають постійні ступені окислення, інші змінні.
Наприклад, до елементів з постійним позитивним ступенем окиснення відносять лужні метали: Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1 , наступні елементи II групи періодичної системи:+2 , Mg +2 , Ca +2 , Sr +2 , +2 , Ra +2 , Zn +2 , а також елемент III групи А - А1+3 та деякі інші. Метали у з'єднаннях завжди мають позитивний ступінь окиснення.
З неметалів постійний негативний ступінь окиснення (-1) має F.
У простих речовинах, утворених атомами металів або неметалів, ступеня окислення елементів дорівнюють нулю, наприклад: Na°, Al°, Fe°, Н 2 0 , 2 0 , F 2 0 , Cl 2 0 , Br 2 0 .
Для водню характерні ступеня окиснення: +1 (Н 2 0) -1 (NaH).
Для кисню характерні ступені окислення: -2 (Н 2 0), -1 (Н 2 Про 2), +2 (OF 2).
Слід пам'ятати, що в цілому молекула електронейтральна, тому в будь-якій молекулі алгебраїчна сума ступенів окислення дорівнює нулю, а в складному іоні – заряду іона.
Наприклад, розрахуємо ступінь окислення хрому в дихроматі калію 2 Cr 2 O 7 .
- Ступінь окиснення калію +1, кисню -2.
- Підрахуємо кількість негативних зарядів: 7 . (-2) = -14
- Число позитивних зарядів має бути + 14. На калій припадає два позитивні заряди, отже, на хром - 12.
- Так як у формулі два атоми хрому, 12 ділимо на два: 12: 2 = 6.
- + 6 – це ступінь окислення хрому.
Перевірка: алгебраїчна сума позитивних та негативних ступенів окислення елементів дорівнює нулю, молекула електронейтральна.
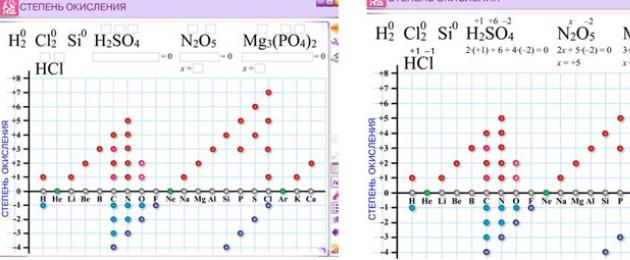
Самостійна робота № 1 по інструктивній карті: користуючись наведеними відомостями, розрахуйте ступені окислення елементів у сполуках: MnO 2, H 2 SO 4 , K 2 SO 3 , H 2 S, KMnO 4.
Що ж є окислювально - відновлювальні реакції з погляду поняття «ступінь окислення хімічних елементів»? (слайд 2)
/ Окисно-відновні реакції- це такі реакції, в яких одночасно протікають процеси окиснення та відновлення і, як правило, змінюються ступеня окиснення елементів.
Розглянемо процес на прикладі взаємодії цинку з розведеною сірчаною кислотою:
Під час упорядкування цього рівняння використовується метод електронного балансу. Метод заснований на порівнянні ступенів окиснення атомів у вихідних речовинах та продуктах реакції. Основна вимога при складанні рівнянь цим методом: кількість відданих електронів має дорівнювати числу прийнятих електронів.
- Окисно-відновні реакції - це такі реакції, при яких відбувається перехід електронів від одних атомів, молекул або іонів до інших.
- Окислення - це процес віддачі електронів, ступінь окислення у своїй підвищується.
- Відновлення - це процес приєднання електронів, ступінь окислення у своїй знижується.
- Атоми, молекули чи іони, що віддають електрони, окислюються; є відновниками.
Атоми, іони чи молекули, які приймають електрони, відновлюються; є окислювачами. - Окислення завжди супроводжується відновленням, відновлення пов'язані з окисленням.
- Окисно - відновлювальні реакції - єдність двох протилежних процесів: окислення та відновлення.
Самостійна робота № 2 по інструктивній карті: методом електронного балансу знайдіть та поставте коефіцієнти в наступній схемі окислювально-відновної реакції:
MnO 2 + H 2 SO 4 → MnSO 4 + O 2 + H 2 O (2MnO 2 + 2H 2 SO 4 → 2MnSO 4 + O 2 +2H 2 O)
Однак навчитися знаходити коефіцієнти в ОВР ще не означає вміти їх складати. Потрібно знати поведінку речовин в ОВР, передбачати перебіг реакцій, визначати склад продуктів, що утворюються в залежності від умов реакції.
Щоб розібратися, яких випадках елементи поводяться як окислювачі, а яких - як відновники, треба звернутися до періодичної системі Д.И.Менделеева. Якщо йдеться про прості речовини, то відновлювальні властивості мають бути притаманні тим елементам, які мають більший у порівнянні з іншими атомний радіус і невелике (1-3) число електронів на зовнішньому енергетичному рівні. Тому вони можуть порівняно легко їх віддавати. Це переважно метали. Найбільш сильними відновними властивостями з них мають лужні та лужноземельні метали, розташовані в головних підгрупах І та ІІ груп (наприклад, натрій, калій, кальцій та ін.).
Найбільш типові неметали, що мають близьку до завершення структуру зовнішнього електронного шару і значно менший у порівнянні з металами того ж періоду атомний радіус, досить легко приймають електрони і поводяться в окислювально-відновних реакціях як окислювачі. Найбільш сильними окислювачами є легкі елементи головних підгруп VI - VII груп, наприклад фтор, хлор, бром, кисень, сірка та ін.
Разом з тим треба пам'ятати, що розподіл простих речовин на окислювачі та відновники так само відносно, як і розподіл на метали та неметали. Якщо неметали потрапляють у середу, де є сильніший окислювач, всі вони можуть виявляти відновлювальні властивості. Елементи в різних ступенях окиснення можуть поводитися по-різному.
Якщо елемент має свій вищий ступінь окислення, він може бути лише окислювачем. Наприклад, у HN+5 O 3 азот може + 5 може бути тільки окислювачем і приймати електрони.
Тільки відновником може бути елемент, що знаходиться в нижчій мірі окислення. Наприклад, N-3 Н 3 азот може -3 може віддавати електрони, тобто. є відновником.
Елементи в проміжних позитивних ступенях окислення можуть, як віддавати, і приймати електрони і, отже, здатні поводитися як окислювачі чи відновники залежно умов. Наприклад, N+3 , S +4 . Потрапляючи у середу із сильним окислювачем, поводяться як відновники. І, навпаки, у відновному середовищі вони поводяться як окислювачі.
За окислювально-відновними властивостями речовини можна розділити на три групи:
- окислювачі
- відновники
- окислювачі – відновники
Самостійна робота № 3 з інструктивної карти: у якій із наведених схем рівнянь реакцій MnO 2
- 2MnO 2 + O 2 + 4KOH = 2K 2 MnO 4 + 2H 2 O (MnO 2 - відновник)
- MnO 2 + 4HCI = MnCI 2 + CI 2 + 2H 2 O (MnO 2 - окислювач)
3. Поглиблення та розширення знань
Найважливіші окислювачі та продукти їх відновлення
1. Сірчана кислота – Н 2 SO 4 є окислювачем
А) Рівняння взаємодії цинку з розведеною Н 2 SO 4 (слайд 3)
Який іон є окислювачем у цій реакції? (H+ )
Продуктом відновлення металом, що стоїть у ряді напруги до водню, є H 2 .
Б) Розглянемо іншу реакцію – взаємодія цинку з концентрованою Н 2 SO 4 (слайд 4)
Які атоми змінюють ступінь окиснення? (цинк та сірка)
Концентрована сірчана кислота (98%) містить 2% води, і сіль утворюється в розчині. У реакції беруть участь фактично сульфат – іони. Продуктом відновлення є сірководень.
Залежно від активності металу продукти відновлення концентрованої Н 2 SO 4 різні: H2S, S, SO2.
2. Інша кислота - азотна - також окислювач за рахунок нітрат - іона NO 3 - . Окислювальна здатність нітрат - іона значно вища за іон H+ , Іон водню не відновлюється до атома, тому при взаємодії азотної кислоти з металами, ніколи не виділяється водень, а утворюються різні сполуки азоту. Це залежить від концентрації кислоти та активності металу. Розведена азотна кислота відновлюється глибше, ніж концентрована (для одного і того ж металу) (слайд 6)
На схемах вказані продукти, вміст яких є максимально серед можливих продуктів відновлення кислот
Золото та платина не реагують з HNO 3 , але ці метали розчиняються в «царській горілці» - суміші концентрованих соляної та азотної кислот у співвідношенні 3:1.
Au + 3HCI (Конц.) + HNO 3 (Конц.) = AuCI 3 + NO + 2H 2 O
3. Найбільш сильним окислювачем у складі простих речовин є фтор. Але він надто активний, і його важко отримати у вільному вигляді. Тому в лабораторіях як окислювач використовуютьперманганат калію KMnO 4 . Його окислювальна здатність залежить від концентрації розчину, температури та середовища.
Створення проблемної ситуації:Я готувала до уроку розчин перманганату калію («марганцівка»), пролила склянку з розчином і забруднила свій улюблений хімічний халат. Запропонуйте (виконавши лабораторний досвід) речовину, за допомогою якої можна очистити халат.
Реакції окислення - відновлення можуть протікати у різних середовищах. Залежно від середовища може змінюватися характер протікання реакції між тими самими речовинами: середовище впливає зміна ступенів окислення атомів.
Зазвичай для створення кислотного середовища додають сірчану кислоту. Соляну та азотну застосовують рідше, т.к. перша здатна окислюватися, а друга сама єсильним окислювачем і може спричинити побічні процеси. Для створення лужного середовища застосовують гідроксид калію або натрію, нейтральне - воду.
Лабораторний досвід:(Правила ТБ)
У чотири пронумеровані пробірки налито по 1-2 мл розчину розведеного перманганату калію. У першу пробірку додайте кілька крапель розчину сірчаної кислоти, у другу - воду, в третю - гідроксид калію, четверту пробірку залиште як контрольну. Потім у перші три пробірки прилийте, обережно збовтуючи, розчин сульфіту натрію. Позначте. Як змінюється фарбування розчину у кожній пробірці. (Слайди 7, 8)
Результати лабораторного досвіду:
Продукти відновлення KMnO 4 (MnO 4 - ):
- у кислому середовищі - Mn+2 (Сіль), безбарвний розчин;
- у нейтральному середовищі - MnO 2, бурий осад;
- у лужному середовищі - MnO 4 2- розчин зеленого кольору. (Слайд 9,)
До схем реакцій:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + КOH → Na 2 SO 4 + K 2 MnO 4 + H 2 O
Підберіть коефіцієнти за допомогою електронного балансу. Вкажіть окислювач та відновник (слайд 10)
(Завдання різнорівневе: сильні учні записують продукти реакції самостійно)
(слайд 11)
Ви зробили лабораторний досвід, запропонуйте речовину, за допомогою якої можна очистити халат.
Демонстраційний досвід:
Плями від розчину перманганату калію швидко виводяться розчином пероксиду водню, підкисленим оцтовою кислотою:
2KMnO 4 + 9H 2 O 2 + 6CH 3 COOH = 2Mn(CH 3 COO) 2 +2CH 3 COOK + 7O 2 + 12H 2 O
Старі плями перманганату калію містять оксид марганцю (IV), тому протікатиме ще одна реакція:
MnO 2 + 3H 2 O 2 + 2CH 3 COOH = Mn(CH 3 COO) 2 + 2O 2 + 4H 2 O (слайд 12)
Після виведення плям шматок тканини необхідно промити водою.
Значення окисно-відновних реакцій
В рамках одного уроку неможливо розглянути все різноманіття окисно-відновних реакцій. Але їхнє значення в хімії, технології, повсякденному житті людини важко переоцінити.
Учень: Окисно-відновні реакції лежать в основі отримання металів та сплавів, водню та галогенів, лугів та лікарських препаратів.
З окислювально-відновними реакціями пов'язано функціонування біологічних мембран, багато природних процесів: обмін речовин, бродіння, дихання, фотосинтез. Без розуміння сутності та механізмів протікання окислювально-відновних реакцій неможливо уявити роботу хімічних джерел струму (акумуляторів та батарей), отримання захисних покриттів, віртуозну обробку металевих поверхонь виробів.
Для цілей відбілювання та дезінфекції користуються окислювальними властивостями таких найбільш відомих засобів, як пероксид водню, перманганат калію, хлор та хлорне, або білильне, вапно.
Хлор як сильний окислювач використовують для стерилізації чистої води та знезараження стічних вод.
4. Закріплення вивченого матеріалу
Тест:
- У кислому середовищі KMnO 4 відновлюється до:
- сіль Mn +2
- MnO 2
- K 2 MnO 4
- Концентрована H 2 SO 4
- Концентрована HNO 3 не реагує з металом:
- Розведена HNO 3
- N 2 O
- Який продукт відновлення KMnO 4 пропущено: 2KMnO 4 + 3K 2 SO 3 + H 2 O = + 3K 2 SO 4 + 2KOH
- MnO 2
- 2MnSO 4
- K 2 MnO 4
(взаємоперевірка тестів у парах)
5. Домашнє завдання
Використовуючи схеми, дані на уроці, закінчіть рівняння реакцій та розставте в них коефіцієнти методом електронного балансу:
- AI + H 2 SO 4 (конц.) →
- Ag + HNO 3 (конц.) →
- KBr + KMnO 4 + H 2 SO 4 → …….. + Br 2 + K 2 SO 4 + H 2 O (слайд 13)
6.Підведення підсумків уроку
Інструктивна картка
I. Повторення та узагальнення вивченого раніше матеріалу
Завдання 1: Розрахуйте ступені окислення елементів у сполуках:
MnO2, H2SO4, K2SO3, H2S, KMnO4.
Завдання 2: Методом електронного балансу знайдіть та поставте коефіцієнти в наступній схемі окисно-відновної реакції:
MnO 2 + H 2 SO 4 → MnSO 4 + O 2 + H 2 O
Завдання 3: В якій із наведених схем рівнянь реакцій MnO 2 проявляє властивості окислювача, а який - властивості відновника:
А) 2MnO 2 + O 2 + 4KOH = 2K 2 MnO 4 + 2H 2 O Б) MnO 2 + 4HCI = MnCI 2 + CI 2 + 2H 2 O
ІІ. Поглиблення та розширення знань:
Лабораторний досвід: (дотримуйтесь правил ТБ)
У чотири пронумеровані пробірки налито по 1-2 мл розчину розведеного перманганату калію. У першу пробірку додайте кілька крапель розчину сірчаної кислоти, в другу - воду, в третю - гідроксиду калію, четверту пробірку залиште контрольною. Потім у перші три пробірки прилийте, обережно збовтуючи, розчин сульфіту натрію.
Позначте як змінюється фарбування розчину в кожній пробірці:
1 пробірка -
2 пробірка -
3 пробірка -
4 пробірка - контроль
Завдання: До схем реакцій:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + КOH → Na 2 SO 4 + K 2 MnO 4 + H 2 O
Підберіть коефіцієнти за допомогою електронного балансу. Вкажіть окислювач та відновник.
ІІІ. Закріплення вивченого матеріалу
Тест:
1.У кислому середовищі KMnO 4 відновлюється до:
А) сіль Mn +2 Б) MnO 2 В) K 2 MnO 4
2.Концентрована H 2 SO 4 при звичайній температурі пасивує:
А) Zn Б) Сu В) AI
3.Концентрована HNO 3 не реагує з металом:
А) Ca Б) Au В) Mg
4.Розбавлена HNO 3 з активними металами відновлюється до:
А) NO Б) N 2 В) N 2 O
5. Який продукт відновлення KMnO 4 пропущено:
2KMnO 4 + 3K 2 SO 3 + H 2 O = + 3K 2 SO 4 + 2KOH
А) MnO 2 Б) 2MnSO 4 В) K 2 MnO 4
Оцінка за тест (за результатами взаємоперевірки)
IV. Домашнє завдання
Використовуючи схеми, дані на уроці, закінчіть рівняння реакцій та розставте в них коефіцієнти:
1. AI + H 2 SO 4 (конц.) →
2. Ag + HNO 3 (конц.) →
3. KBr + KMnO 4 + H 2 SO 4 → …….. + Br 2 + K 2 SO 4 + H 2 O
Розробка уроків (конспекти уроків)
Основна загальна освіта
Лінія УМК О. С. Габрієляна. Хімія (8-9)
Увага! Адміністрація сайту сайт не несе відповідальності за зміст методичних розробок, а також за відповідність розробці ФГОС.
Використана література:
- Настільна книга вчителя хімії. 8 клас. О.С. Габрієлян, Н.П.Воскобойнікова, А.В.Яшукова (М.:Дрофа). 2003р.
- ЕФУ Хімія 8 клас. О.С. Габрієлян, (М.:Дрофа).
- Робочий зошит до підручника О.С. Габрієляна Хімія 8 клас. О.С. Габрієлян, А.С. Солодков (М.:Дрофа-2013).
Цілі уроку:
- навчальні:познайомити учнів із новою класифікацією хімічних реакцій за ознакою зміни ступенів окислень елементів – окислювально-відновними реакціями, повторити поняття “окислювач”, “відновник”, “окислення”, “відновлення”;
- розвиваючі: продовжити розвиток логічного мислення, формування інтересу до предмета, використовуючи сучасні технології навчання.
- виховні:формувати науковий світогляд учнів, формування культури міжособистісного спілкування: оцінювати свою роботу.
Засоби навчання:
- Електронна програма до підручника «Хімія 8 клас». О.С. Габрієлян, (М.:Дрофа).
- Інтерактивний навчальний посібник «НАГЛЯДНА ХІМІЯ. Хімія. 8-9 клас. Москва: ТОВ «Іспит-Медіа» 2011-2013
Підручник: ЕФУГабрієлян О.С. Хімія.8 клас: - М.: Дрофа, 2015
Хід уроку
1. Організаційний етап
Підготовка учнів до роботи на уроці. Правила роботи та ТВ у смарт-класі при роботі з ноутбуками
2. Актуалізація знань учнів
а)Згадаймо всі відомі вам класифікації хімічних реакцій та ознаки, що лежать в основі кожної класифікації. Повторення. "Типи хімічних реакцій" (засобом навчання 2)
Робота з літератури 1:
1. За типом і складом речовин, що реагують і утворюються, бувають реакції:
а) з'єднання;
б) розкладання;
в) заміщення;
г) обміну (зокрема і реакція нейтралізації).
2. За агрегатним станом речовин (фазі) розрізняють реакції:
а) гомогенні;
б) гетерогенні.
3. За тепловим ефектом реакції поділяються на:
а) екзотермічні (зокрема реакції горіння);
б) ендотермічні.
4. За використанням каталізатора виділяють реакції:
а) каталітичні (у тому числі ферментативні);
б) некаталітичні.
5. У напрямку розрізняють реакції:
а) оборотні;
б) незворотні.
Б)Дати повну характеристику реакції синтезу оксиду сірки(6) з оксиду сірки(4) та кисню:
3. Засвоєння нових знань з ЕФУ
а)Згадаймо, що таке С.О. і як він змінюється за ХР. (Повторення з наступною перевіркою засобом навчання 2.)

Б) Пояснення матеріалу з ЕФУстор. 263–265.


в)Робота з електронним додатком ЕФУ.

Г) Робота з літератури 2

4. Первинне закріплення знань
а)Учні виконують завдання. ЕЛЕКТРОННОГО ДОДАТКУ

При скруті використовуємо стор. 264-265 ЕФЗ.
Б)Виконує завдання по електронному додатку, знаходження окислювача, відновника, перехід електронів, робота біля дошки.
Олександрова Анфіса Михайлівна
Вчитель хімії
МОУ «Приволзька середня загальноосвітня школа» Волзького району РМЕ
Тема: «Окисно-відновні реакції»
Тип уроку: урок – узагальнення та повторення матеріалу із поєднанням фронтального, парного та індивідуального виду роботи учнів.
Вигляд уроку- Пояснювально-ілюстративний.
Методи та методичні прийоми.Словесно-наочні та демонстраційно-практичні. Самостійна робота з знаходження правильних відповідей, обговорення вибраної відповіді, лабораторний досвід з наступним написанням рівнянь реакцій, обговорення результатів роботи.
Ціль: поглиблення знань щодо складання рівнянь ОВР методом електронного балансу.
Завдання уроку:
Освітні: повторити основні поняття про процеси окислення та відновлення, ступеня окислення, окислювачів і відновників, розглянути сутність окислювально-відновлювальних реакцій, виробити вміння щодо складання рівнянь хімічних реакцій, що протікають у різних середовищах методом електронного балансу.
Розвиваючі: сприяти формуванню та розвитку пізнавального інтересу учнів до предмета, сприяти розвитку мовлення учнів, формування вміння аналізувати, зіставляти та узагальнювати знання на тему.
Виховні:виховання усвідомленої потреби у знаннях, удосконалювати вміння вислуховувати думку кожного члена колективу.
Реактиви: розчини калію перманганату, сірчаної кислоти, сульфіту натрію, вода.
Обладнання: пробірки, піпетки.
План уроку:
I. Актуалізація знань.
V. Домашнє завдання.
VI. Рефлексія та підбиття підсумків.
Девіз уроку: «Хтось втрачає, а хтось знаходить…»
I. Актуалізація знань.
Розмова щодо раніше вивченого матеріалу.
1) Які реакції називаються окислювально-відновними?
Окислювально - відновлювальні реакції – це реакції, у яких відбувається перехід електронів від одних атомів, молекул чи іонів до іншим.
2) Що таке процес окиснення?
Окислення – це процес віддачі електронів, ступінь окислення у своїй підвищується.
3) Який процес називається відновленням?
Відновлення – це процес приєднання електронів, ступінь окислення у своїй знижується.
4) Як називаються частинки, що віддають електрони?
Атоми, молекули чи іони, що віддають електрони, окислюються; є відновниками.
5) Як називаються частинки, які приймають електрони?
Атоми, іони чи молекули, які приймають електрони, відновлюються; є окислювачами.
6) Що таке «ступінь окислення»?
Ступінь окислення - це умовний заряд атома в молекулі, обчислений у припущенні, що молекула складається з іонів та в цілому електронейтральна (умовний заряд атома, який ми приписуємо йому у разі прийняття чи віддачі електронів).
7) Який метод складання рівняння окисно-відновних реакцій ви знаєте? Яке правило є основою цього?
Самостійна робота учнів біля дошки за картками (з обговоренням).
1. Визначте валентність та ступеня окислення елементів у наступних сполуках:
СН 4 , Cl 2 , СО 2 , NH 3 , C 2 H 4 , СН 3 СOOH, V 2 O 5 , Na 2 B 4 O 7 , KClO 4 , K 2 HPO 4 , Na 2 Cr 2 O 7 .
Відповідь: Для виконання завдання можна використовувати програму 1.
ІV ІІІ ІІІ ІІІ ІІІ ІІІ ІІІ ІІІ ІІІ
З -4 Н +1 4 , Cl 0 2 , С +4 Про -2 2 , N -3 H +1 3 , C -2 2 H +1 4 , С -3 Н +1 3 С +3 O -2 O -2 H +1 , V +5 2 O -2 5 ,
I VII II I I V II I VI II
K +1 Cl +7 O -2 4 , K +1 2 H +1 P +5 O -2 4 Na +1 2 Cr +6 2 O -2 7 .
2. У яких із наведених нижче рівнянь реакцій MnО 2 виявляє властивості окислювача, а яких – відновника?
а ) 2MnO 2 + 2H 2 SO 4 2MnSO 4 + O 2 + 2H 2 O;
б ) 2MnO 2 + O 2 + 4KOH 2K 2 MnO 4 + 2H 2 O;
в ) MnO 2 + H 2 = MnO + H 2 O;
г ) 2MnO 2 + 3NaBiO 3 + 6HNO 3 = 2HMnO 4 + 3BiONO 3 + 3NaNO 3 + 2H 2 O
Відповідь:
Окислювач приймає електрони і при цьому ступінь окислення знижується, отже, у випадках аі в MnО 2 є окислювачем. Відновник віддає електрони і при цьому ступінь окислення підвищується, отже, у випадках бі г MnО 2 є відновником.
ІІ. Мотивація та цілепокладання.
Окисно-відновні реакції надзвичайно поширені. З ними пов'язані, наприклад, процеси дихання та обміну речовин, що протікають у живому організмі, гниття та бродіння, фотосинтез. Окисно-відновні процеси супроводжують круговороти речовин у природі. Їх можна спостерігати при згорянні палива, у процесах корозії металів, при електролізі та виплавці металів. З їх допомогою отримують луги та кислоти, а також багато інших цінних продуктів. Окисно-відновні реакції лежать в основі перетворення хімічної енергії в електричну енергію в гальванічних та паливних елементах.
Проблема: Я готувала до уроку розчин перманганату калію («марганцівка»), пролила склянку з розчином і забруднила свій улюблений хімічний халат Запропонуйте (виконавши лабораторний досвід) речовину, за допомогою якої можна очистити халат.
ІІІ. Відпрацювання та розширення знань.
Реакції окислення – відновлення можуть відбуватися у різних середовищах. Залежно від середовища може змінюватися характер протікання реакції між тими самими речовинами: середовище впливає зміна ступенів окислення атомів.
Зазвичай для створення кислотного середовища додають сірчану кислоту. Соляну та азотну застосовують рідше, т.к. перша здатна окислюватися, а друга сама є сильним окислювачем і може спричинити побічні процеси. Для створення лужного середовища застосовують гідроксид калію або натрію, нейтральне – воду.
Лабораторний досвід: (правила ТБ)
У чотири пронумеровані пробірки налито по 1-2 мл розчину розведеного перманганату калію. У першу пробірку додайте кілька крапель розчину сірчаної кислоти, у другу – воду, у третю – гідроксид калію, четверту пробірку залиште як контрольну. Потім у перші три пробірки прилийте, обережно збовтуючи, розчин сульфіту натрію. Зауважте, як змінюється фарбування розчину в кожній пробірці.
Результати лабораторного досвіду:
Продукти відновлення KMnO 4 (MnO 4 - ):
у кислому середовищі – Mn +2 (сіль), безбарвний розчин;
в нейтральному середовищі - MnO 2 бурий осад;
в лужному середовищі - MnO 4 2 - розчин зеленого кольору.
Завдання . Дані схеми реакцій:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + KOH → K 2 MnO 4 +Na 2 SO 4 + H 2 O
Завдання різнорівневе: сильні учні записують продукти реакції самостійно:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 →
KMnO 4 + Na 2 SO 3 + H 2 O →
KMnO 4 + Na 2 SO 3 + КOH →
Підберіть коефіцієнти методом електронного балансу за алгоритмом (Додаток 1). Вкажіть окислювач та відновник.
Відповідь:
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 → 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
2KMnO 4 + 3Na 2 SO 3 + H 2 O → 2MnO 2 ↓ + 3Na 2 SO 4 + 2KOH
2KMnO 4 + Na 2 SO 3 + 2KOH → 2K 2 MnO 4 +Na 2 SO 4 + H 2 O
Ви зробили лабораторний досвід, запропонуйте речовину, за допомогою якої можна очистити халат.
У наведених нижче схемах наведено продукти реакцій. Вкажіть реагенти, складіть рівняння реакцій, використовуючи метод електронного балансу:
(учні працюють у парах)
а) KI + КMnO 4 +. . . ->MnSO 4 + I 2 + K 2 SO 4 + H2O
Відповідь: тому що в результаті реакції виходить Mn +2, отже процес протікає в кислому середовищі за участю сірчаної кислоти і утворюється сульфат калію.
10KI + 2 КMnO 4 + 8H 2 SO 4 = 2MnSO 4 + 5I 2 + 6K 2 SO 4 +8H 2 O
2I -1 -2e -> I 2 0 5 - окислення, відновник
Mn +7 + 5e -> Mn +2 2- відновлення, окислювач
б ) NaI + КMnO 4 + . . . -> I 2 + K 2 MnO 4 + NaOH
Відповідь: т.к в результаті реакції виходить K 2 MnO 4 отже процес протікає в лужному середовищі за участю гідроксиду калію
2NaI + 2 КMnO 4 + 2KOH = I 2 + 2K 2 MnO 4 + 2NaOH
2I -1 -2e -> I 2 0 1- окислення, відновник
Mn +7 + 1e -> Mn +6 2- відновлення, окислювач
в ). . . + КMnO 4 + H 2 O -> NaNO 3 + MnO 2 + KOH
Відповідь: у цій реакції окислювач КMnO 4 відомий, легко припустити, що відновлюється нітрит натрію, де N +3 до нітрату:
3 NaNO 2 + 2 КMnO 4 + H 2 O = 3NaNO 3 + 2MnO 2 + 2KOH,
N +3 - 2e -> N +5 3 - окислення, відновник
Mn +7 + 3e -> Mn +4 2 - відновлення, окислювач
Крім перманганату калію окислювальною здатністю мають інші речовини. Можна з ними познайомитись у додатку 2.
1) H 2 SO 4 (розведена), окислювачН+1
Продукт відновлення металом, що стоїть у ряді напруги до водню, - Н2.
Наприклад,
H 2 SO 4 (розб.) + Zn -> ZnSO 4 + H 2
H 2 SO 4 (розб.) + Cu не реагує.
2) H 2 SO 4 (концентрована), окислювач S +6
Залежно від активності металу продукти відновлення концентрованої H 2 SO 4 різні: H 2 S; S; SO 2 . Продукт відновлення також залежить від концентрації кислоти (таблиця 18 стор.250 підручника).
3) HNO 3 окислювач N +5 (Таблиця 18 стор.250 підручника).
Концентрована HNO 3 пасивує такі метали, як Fe, Cr, Al, що пов'язано з утворенням на поверхні цих металів тонкої, але дуже щільної оксидної плівки.
Au і Pt не реагують з HNO 3 але ці метали розчиняються в «царській горілці» - суміші концентрованих соляної та азотної кислот у співвідношенні 3: 1.
Наприклад:
Au + 3HCl (Конц.) + HNO 3 (Конц.) = AuCl 3 + NO + 2H 2 O.
4) До 2 С r 2 O 7 у кислому середовищі відновлюється до Cr 3+
у нейтральному середовищі до Сr 2 O 3
у лужному середовищі до CrO 4 2-
Окисно-відновні реакції в органічній хімії пов'язано або з утворенням зв'язків по кисню, або з відщепленням водню.
Правило утворення зв'язків: - ВІН → -1е
Про → -2е
відщеплення 1атома Н → -1е
I V. Закріплення дослідженого матеріалу.
Як закріплення пройденого матеріалу пропоную тестові завдання.
Варіант 1
1. Який із неметалів є сильним окислювачем?
1) фтор 2) сірка 3) озон 4) кремній
2. Ступінь окислення сірки у сульфаті калію дорівнює
1)+6 2)+4 3)0 4)-2
3. У якому з наведених реакцій атом хлору виступає у ролі відновника
1) Cu + Cl 2 = CuCl 2
2) HCl + NaOH = NaCl + H 2 O
3) HCl + MnO 2 = MnCl 2 + Cl 2 + H 2 O
4) Cl 2 + H 2 = HCl
5) +2 → 0
6) 0 → - 1
5. Використовуючи метод електронного балансу скласти рівняння реакції:
PbS + H 2 O 2 →PbSO 4 + H 2 O
6. Використовуючи метод електронного балансу скласти рівняння реакції:
KBr + KMnO 4 + H 2 SO 4 → …….. + Br 2 + K 2 SO 4 + H 2 O
Визначте окислювач та відновник.
Відповідь: 1-1; 2-1; 3-3; 4-А3, Б4, В2, Г5.
Варіант 2
1. У якому з перерахованих сполук атом сірки перебуває у ступені окислення +6
1) FeSO 3 2) S 3) SO 2 4) До 2 SO 4
2. Який елемент відновлюється в реакції Fe2O3+CO=Fe+СО2
1)залізо 2)кисень 3)вуглець
3. Виберіть рівняння реакції, в якому елемент вуглець є окислювачем.
1)2 С + O 2 = 2CO
2) CO 2 + 2Mg = 2MgO + C
3) CH 4 + 2O 2 = CO 2 + 2H 2 O
4) C + 2H 2 SO 4 = CO 2 + 2H 2 O + 2SO 2
4. Встановіть відповідність між рівнянням реакції та зміною ступеня окислення окислювача в даній реакції:
Зрівняння реакції Зміна ступеня окислення окислювача
A) S О 2 + N О 2 = S О 3 +NO 1) -1 → 0
Б) 2NH 3 + 2Na = 2NaNH 2 + H 2 2) 0 → -2
В) 4N О 2 + О 2 + 2H 2 О = 4HN О 3 3) +4 → +2
Г) 4NH 3 + 6NO = 5N 2 + 6Н 2 Про 4) +1 → 0
5) +2 → 0
6) 0 → - 1
5. Використовуючи метод електронного балансу, складіть рівняння реакції:
NaNO 2 + NH 4 Cl → NaCl + 2H 2 O + N 2
Визначте окислювач та відновник.
6. Використовуючи метод електронного балансу, складіть рівняння реакції:
KI+H 2 SO 4 + NaNO 2 → …… + K 2 SO 4 + Na 2 SO 4 + NO + H 2 O
Визначте окислювач та відновник.
Відповідь: 1-4; 2-1; 3-2; 4-А3, Б4, В2, Г5.
V. Домашнє завдання.
1. Допишіть рівняння реакцій та розставте коефіцієнти за допомогою методу електронного балансу:
1. K 2 Cr 2 O 7 + KNO 2 + …….→ KNO 3 + Cr 2 (SO 4 ) 3 + …..+H 2 O
2. C 6 H 5 -CH 3 + KMnO 4 + H 2 SO 4 → C 6 H 5 COOH +….+….+…..
3. З 2 Н 5 ОН + К 2 Сr 2 O 7 + H 2 SO 4 → CH 3 COOH +….+….+…..
4.Na 2 SO 3 + До 2 Сr 2 O 7 + H 2 SO 4 → ….+….+….+…..
2. Складіть рівняння окислення формальдегіду розчином перманганату калію, підкисленим сірчаною кислотою з урахуванням того, що формальдегід окислюється до СО 2 коефіцієнти підберіть методом електронного балансу. 2
з'єднаннях зазвичай дорівнює - 2, крім H 2 O 2 -1 та ОF 2.
4. Ступінь окислення атома водню в
з'єднаннях зазвичай дорівнює +1, крімМеH (гідриди).
5.Алгебраїчна сума ступенів окислення
елементів у з'єднаннях дорівнює 0.
Ступінь окислення
Окисно-відновні властивості речовин
Види реакцій окислення-відновлення
Напрямок окисно-відновних реакцій
До окислювально-відновних реакцій відносяться такі, що супроводжуються переміщенням електронів від одних частинок до інших. Під час розгляду закономірностей перебігу окислювально-відновних реакцій використовується поняття ступеня окислення.
1. Ступінь окиснення
Концепція ступеня окисленнявведено для характеристики стану елементів у з'єднаннях. Під ступенем окислення розуміється умовний заряд атома в поєднанні, обчислений виходячи з припущення, що з'єднання складається з іонів. Ступінь окислення позначається арабською цифрою зі знаком плюс при зміщенні електронів від даного атома до іншого атома та цифрою зі знаком мінус при зміщенні електронів у зворотному напрямку. Цифру зі знаком "+" або "-" ставлять над символом елемента. Ступінь окислення вказує стан окислення атома і являє собою лише зручну форму для обліку перенесення електронів: її не слід розглядати ні як ефективний заряд атома в молекулі (наприклад, в молекулі LiF ефективні заряди Li і F рівні відповідно + 0,89 і -0, 89, тоді як ступеня окиснення +1 і -1), ні як валентність елемента (наприклад, у сполуках CH 4 , CH 3 OH, HCOOH, CO 2 валентність вуглецю дорівнює 4, а ступеня окиснення відповідно дорівнюють -4, -2, + 2, +4). Чисельні значення валентності та ступеня окислення можуть збігатися по абсолютній величині лише при утворенні сполук з іонною структурою.
При визначенні ступеня окиснення використовують такі правила:
Атоми елементів, що знаходяться у вільному стані або у вигляді молекул простих речовин, мають ступінь окислення, що дорівнює нулю, наприклад Fe, Cu, H 2 , N 2 і т.п.
Ступінь окислення елемента у вигляді одноатомного іона у поєднанні, що має іонну будову, дорівнює заряду даного іона,
1 -1 +2 -2 +3 -1
наприклад, NaCl, Cu S, AlF 3 .
Водень у більшості сполук має ступінь окиснення +1, за винятком гідридів металів (NaH, LiH), у яких ступінь окиснення водню дорівнює -1.
Найбільш поширена ступінь окиснення кисню в сполуках -2, за винятком пероксидів (Na 2 O 2 , Н 2 О 2), в яких ступінь окиснення кисню дорівнює -1 і F 2 O, в якому ступінь окиснення кисню дорівнює +2.
Для елементів з непостійним ступенем окиснення її значення можна розрахувати, знаючи формулу з'єднання та враховуючи, що алгебраїчна сума ступенів окиснення всіх елементів у нейтральній молекулі дорівнює нулю. У складному іоні ця сума дорівнює заряду іона. Наприклад, ступінь окиснення атома хлору в молекулі HClO 4 , обчислена виходячи із сумарного заряду молекули = 0, де х – ступінь окиснення атома хлору), дорівнює +7. Ступінь окислення атома сірки в іоні (SO 4) 2-[х + 4(-2) = -2] дорівнює +6.
2. Окисно-відновні властивості речовин
Будь-яка окислювально-відновна реакція складається з процесів окислення та відновлення. Окислення - це процес віддачі електронів атомом, іоном чи молекулою реагенту. Речовини, що віддають свої електрони в процесі реакції і при цьому окислюються відновниками.
Відновлення - це процес прийняття електронів атомом, іоном чи молекулою реагенту.
Речовини, які приймають електрони та при цьому відновлюються, називають окислювачами.
Реакції окислення-відновлення завжди протікають як єдиний процес, що називається окисно-відновною реакцією.Наприклад, при взаємодії металевого цинку з іонами міді. відновник(Zn) віддає свої електрони окислювачу– іонам міді (Cu 2+):
Zn + Cu 2+ Zn 2+ + Cu
Мідь виділяється на поверхні цинку, а іони цинку переходять у розчин.
Окислювально-відновлювальні властивості елементів пов'язані з будовою їх атомів та визначаються положенням у періодичній системі Д.І. Менделєєва. Відновлювальна здатність елемента обумовлена слабким зв'язком валентних електронів із ядром. Атоми металів, що містять зовнішньому енергетичному рівні невелика кількість електронів схильні до їхньої віддачі, тобто. легко окислюються, граючи роль відновників. Найсильніші відновники – найактивніші метали.
Критерієм окислювально-відновної активності елементів може бути їх величина відносної електронегативності: чим вона вище, тим сильніше виражена окислювальна здатність елемента, і чим нижче, тим яскравіше проявляється його відновлювальна активність. Атоми неметалів (наприклад, F, O) мають високе значення спорідненості до електрона і відносної електронегативності, вони легко приймають електрони, тобто. є окислювачами.
Окисно-відновні властивості елемента залежать від ступеня його окиснення. У того самого елемента розрізняють нижчу, високу та проміжні ступеня окислення.
Як приклад розглянемо сірку S та її сполуки H 2 S, SO 2 та SO 3 . Зв'язок між електронною структурою атома сірки та його окислювально-відновними властивостями у цих сполуках наочно представлений у таблиці 3.1.
У молекулі H 2 S атом сірки має стійку октетну конфігурацію зовнішнього енергетичного рівня 3s 2 3p 6 і тому більше не може приєднувати електрони, але може їх віддавати.
Стан атома, у якому він може більше приймати електрони, називається нижчою ступенем окислення.
Нижчою мірою окислення атом втрачає окислювальну здатність і може бути тільки відновником.
Таблиця 1.
|
Формула речовини |
Електронна формула |
Окисно-відновні властивості |
|
|
|
1s 2 2s 2 2p 6 3s 2 3p 6 |
|
|
|
|
1s 2 2s 2 2p 6 3s 2 3p 4 |
окислювач |
відновник |
|
|
1s 2 2s 2 2p 6 3s 2 3p o |
окислювач |
|
|
|
1s 2 2s 2 2p 6 3s o 3p 0 |
окислювач |
|
У молекулі SO 3 всі зовнішні електрони атома сірки зміщені до атомів кисню. Отже, у цьому випадку атом сірки може приймати електрони, проявляючи окислювальні властивості.
Стан атома, в якому він віддав усі валентні електрони, називається найвищим ступенем окислення.Атом, що перебуває у вищому ступені окислення, може бути лише окислювачем.
У молекулі SO 2 і елементарної сірки S атом сірки знаходиться в проміжних ступенях окиснення, тобто, маючи валентні електрони, атом може їх віддавати, але, не маючи завершеного р -підрівня, може приймати електрони до його завершення.
Атом елемента, що має проміжний ступінь окислення, може виявляти як окислювальні, так і відновлювальні властивості, що визначається його роллю конкретної реакції.
Так, наприклад, роль сульфіт - аніону SO  у наступних реакціях різна:
у наступних реакціях різна:
5Na 2 SO 3 +2KMnO 4 + 3H 2 SO 4 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O (1)
H 2 SO 3 + 2 H 2 S 3 S + 3 H 2 O (2)
В реакції (1) сульфіт-аніон SO  у присутності сильного окислювача KMnO 4 відіграє роль відновника; в реакції (2) сульфіт-аніон SO
у присутності сильного окислювача KMnO 4 відіграє роль відновника; в реакції (2) сульфіт-аніон SO  - окислювач, оскільки H 2 S може виявляти лише відновлювальні властивості.
- окислювач, оскільки H 2 S може виявляти лише відновлювальні властивості.
Таким чином, серед складних речовин відновникамиможуть бути:
1. Прості речовини, атоми яких мають низькі значення енергії іонізації та електронегативності (зокрема, метали).
2. Складні речовини, що містять атоми в нижчих ступенях окиснення:
H Cl,H 2 S,N H 3
Na 2 S O 3 , Fe Cl 2 , Sn(NO 3) 2 .
Окислювачамиможуть бути:
1. Прості речовини, атоми яких мають високі значення спорідненості до електрона і електронегативності - неметали.
2. Складні речовини, що містять атоми у вищих ступенях окиснення: +7 +6 +7
K Mn O 4 , K 2 Cr 2 O 7 , HClO 4 .
3. Складні речовини, що містять атоми в проміжних ступенях окиснення:
Na 2 S O 3 , Mn O 2 , Mn SO 4 .
- Вконтакте 0
- Google+ 0
- ОК 0
- Facebook 0



 –2
–2

 ;
;
 - 6
- 6

 ;
;
 - 8
- 8

 відновник
відновник

 +
2
+
2


 –4
–4

 ;
; -
6
-
6




 +
4
+
4 

 ;
; +
6
+
6


 -2
-2

 відновник
відновник

 +
2
+
2

 ;
;
 + 6
+ 6

 ;
; +
8
+
8