2 Lecție de chimie în clasa a VIII-a pe tema „Reacții oxidativ-oxidative”
Abstract: Lecție de chimie pe tema „Oxidarea în reacții pozitive” pentru elevii clasei a VIII-a. În cadrul lecției sunt dezvăluite conceptele de bază despre reacțiile oxidative: stadiul de oxidare, oxidare, reacție, oxidare, reînnoire: stocarea înregistrărilor OVR se formează prin metoda bilanţului electronic.
Lecție de chimie pentru clasa a VIII-a pe tema
„Oxidativ – într-o reacție pozitivă”
META LECȚIA: să formuleze un sistem de cunoștințe despre reacțiile oxidative, să învețe să întocmească înregistrări OVR folosind metoda echilibrului electronic.
OBIECTIVUL LECȚIEI:
Acasă: priviți esența proceselor de oxidare, învățați să definiți „etapa de oxidare” pentru identificarea proceselor de oxidare și reînnoire; învață să compare înregistrările reacțiilor oxidative folosind metoda echilibrului electronic.
în curs de dezvoltare: determinați cu atenție tipul de reacție chimică, analizând stadiul de oxidare a atomilor din substanțe; învață elementele de bază, exersează cu algoritmi, distilează-ți interesul într-un subiect.
Vihovoyut: să formuleze nevoia de activitate cognitivă și valoarea cunoștințelor; analizează caracteristicile prietenilor tăi, prezice rezultatele muncii tale, evaluează-ți munca; să dezvolte o cultură a învățării prin lucrul în perechi „învățător-învățator”, „cititor-învățător”.
Tip de lecție: Lecție despre învățarea de materiale noi.
Metode de utilizat în clasă: Poyasnyuvalno-mule ilustrativ.
Înțelegeți ce să introduceți în clasă: reacții oxidative; oxidant; jurnal; proces de oxidare; proces de reînnoire.
Vikoristovuvane obladnannyata reacti: tabelul diviziunilor, sistemul periodic D. I. Mendeleev, acid clorhidric, acid sulfuric, granule de zinc, așchii de magneziu, sulfat de cupru, flori de buruieni.
Forma robotică: Individual, frontal.
Ora lecției: (90 ore, 2 lecții).
Progresul lecției
eu . Moment organizatoric
II . Revizuirea materialului acoperit
CITITOR: Copii, haideți să trecem în revistă materialul despre stadiul de oxidare, de care vom avea nevoie în clasă, înainte de a învăța.
Dormit frontal:
Ce este electronegativitatea?
Care este etapa de oxidare?
Cum poate fi adusă la zero stadiul de oxidare al unui element? În ce fel de situații?
Care etapă de oxidare dezvăluie cel mai adesea acru la spelunk?
Ghiciți vina.
Ce stadiu de oxidare prezintă metalele în compușii polari și ionici?
Cum se rezolvă etapa de oxidare din spatele formulelor?
Etapa de oxidare a acidului este întotdeauna mai mare decât -2.
Etapa de oxidare a apei poate crește întotdeauna la +1.
Etapa de oxidare a metalelor este întotdeauna pozitivă și, în măsura maximă posibilă, este întotdeauna egală cu numărul grupului.
Etapa de oxidare a atomilor liberi și a atomilor din compușii simpli va fi întotdeauna 0.
Etapa totală de oxidare a atomilor tuturor elementelor din specia dată este 0.
VERIFICATOR introduce invataturile de consolidare a regulilor formulate de intelegere - sa cunoasca stadiul de oxidare a elementelor in cuvinte simple si jumatati de cuvinte:
S, H2, H3P04, NaHS03, HN03Cu (N02)2, NO2Ba, Al.
De exemplu: Care va fi etapa de oxidare a sulfului în acid sulfuric?
În molecule, suma algebrică a etapelor de oxidare a elementelor cu ordinea numărului lor de atomi este egală cu 0.
H2+1SxO4-2
(+1) * 2 + X * 1 + (-2) . 4 = 0
X = + 6
H2+1S+6O4-2
III . Dezvoltarea de material nou
CITITOR: Diversitatea clasificării reacțiilor chimice cu semne diferite (direct, numărul și compoziția substanțelor de reacție și coagulare, vecinătatea catalizatorului, efectul termic) Puteți adăuga încă un semn. Acest semn este o modificare a stadiului de oxidare a atomilor elementelor chimice care creează substanțele care reacționează.
În spatele acestui semn reacțiile sunt diferențiate
Reacții chimice
Reacții care au loc fără modificare Reacții care au loc fără modificare Etapa de oxidare a elementelor Etapa de oxidare a elementelor
De exemplu, reacția
1 +5 -2 +1 -1 +1 -1 +1 +5 -2
AgNO3 + HCI AgCl + HNO3
Etapele de oxidare a atomilor elementelor chimice nu s-au schimbat după reacție. Și axa din cealaltă reacție este interacțiunea acidului clorhidric cu zincul
2HCI + Zn ZnCI2 + H2
Atomii a două elemente, apă și zinc, și-au schimbat etapele de oxidare: apa de la +1 la 0 și zincul de la 0 la +2. Deci, în această reacție, atomul de apă este îndepărtat prin îndepărtarea câte un electron
2H + 2eH2
iar atomul de zinc din piele a dat doi electroni
Zn - 2е Zn
CITITOR: Ce tipuri de reacții chimice cunoașteți?
ÎNVĂȚA: Toate reacțiile de substituție, precum și acele reacții de cuplare și expansiune la care participă, sunt efectuate înainte de ORR. Aș dori un discurs simplu.
CITITOR: Datele atribuite OVR.
Reacțiile chimice care au ca rezultat modificarea etapelor de oxidare ale atomilor elementelor chimice sau ionilor care creează compușii care reacţionează se numesc oxidativ – reacții noi.
CITITOR: Copii, înțelegeți că reacțiile cauzate de oxidare nu sunt pozitive:
1) 2Na + CI2 = 2NaCl
2) Na CL + AgNO3 = NaNO3 +AgCl↓
3) Zn + 2HCI = ZnCl 2 + H2
4) S + O2 = SO2
UCHNI: viconuyut zadannya
CITITOR: Modul în care este aplicat OVR este demonstrat de probele ofensive.
H2S04 + Mg MgS04 + H2
Etapa de oxidare a tuturor elementelor din formulele reactanților și produșilor acestei reacții este semnificativă:
După cum se poate observa din reacția similară, atomii a două elemente, magneziu și apă, și-au schimbat etapele de oxidare.
Ce s-a întâmplat cu ei?
Magneziul dintr-un atom neutru este transformat într-un ion metil la etapa de oxidare +2, dând 2e:
Mg 0 - 2e Mg +2
Scrieți în notele dvs.:
Elementele sau cuvintele pe care electronica le furnizează sunt numite vidnovnikami;în timpul reacţiei de duhoare oxida.
Ionul mental H în stadiul de oxidare +1 s-a transformat într-un atom neutru, apoi atomul de piele a pierdut câte un electron.
2Н +1 +2е Н 2
Se numesc elemente sau discursuri care acceptă electronica oxidanţi; în timpul reacţiei de duhoare Sunt reînnoit.<Приложение 1>
Aceste procese pot fi transmise folosind următoarea diagramă:
Acid clorhidric + sulfat de magneziu magneziu + apa
CuSO 4 + Fe (floare purpurie) = Fe SO 4 + Cu (floare roșie frumoasă)
Fe 0 – 2 eFe +2
Cu +2 +2 eCu 0
Procesul de a da electroni se numește oxidareși acceptă - actualizări.
Procesul are o etapă de oxidare. a merge inainte, în curs de reînnoire – este în scădere.
Aceste procese sunt indisolubil legate între ele.
CITITOR: Să aruncăm o privire asupra istoriei și să o descriem în detaliu.
Zavdannya: Pentru reacțiile oxid-oxid, selectați oxidant și reactor, procesele de oxidare și reînnoire, adăugați ecuațiile electronice:
1) BaO + SO 2 = BaSO 3
2) CuCl 2 + Fe = FeCl 2 + Cu
3) Li + O 2 = Li 2 O 3
4) CuSO 4 + 2KOH = Cu(OH) 2 ↓ + K 2 SO 4
II parte a lecției (a 2-a lecție)
Metoda echilibrului electronic ca metodă de pliere a nivelurilor OVR
În continuare, ne vom uita la nivelul reacțiilor oxidative folosind metoda echilibrului electronic. Metoda echilibrului electronic se bazează pe următoarea regulă: numărul total de electroni furnizați de generator este egal cu aceeași cantitate de electroni furnizată de oxidant.
După ce explică predarea aflată în grija profesorului, OVR urmează planurile pe care profesorul le-a spus înainte de această lecție. <Приложение 2>.
Mementourile apar la birou de la biroul fiecărui student.
CITITOR: Printre reacțiile pe care le-am dezvoltat până la reacțiile oxid-oxid sunt:
Interacţiune metale cu nemetale
2Mg + O2 = 2MgO
Oxidare O 2 +4e 2O -2 1 actualizare
2. Interacțiune metale din acid.
H2S04 + Mg = MgS04 + H2
Vіdnovnik Mg 0 -2e Mg +2 2 oxidare
Oxigen 2O -2 +4e O 2 0 1 actualizare
3. Mutualism metale din metale.
Cu S04 + Mg = MgS04 + Cu
Vіdnovnik Mg 0 -2e Mg +2 2 oxidare
Oxigen Cu +2 +2e Cu 0 1 actualizare
Reacția este dictată; un om de știință realizează independent o diagramă a reacției tablei albe:
H 2 + O 2 → H 2 O
Este semnificativ faptul că atomii unor elemente modifică stadiul de oxidare.
(H2° + O2° → H2O2).
Procesele electronice de oxidare și reînnoire sunt complexe.
(H 2 ° -2e → 2H + - proces de oxidare,
O 2 ° +4e → 2O - ² - proces de reînnoire,
N 2 - vidnovnik, Pro 2 - oxidant)
Vom selecta o locație separată pentru depunerea și acceptarea acelorași coeficienți pentru conturile electronice.
(∙2| Н 2 °-2е → 2Н + - proces de oxidare, element – descendent;
∙1| O 2 ° +4e → 2O - ² – proces de reînnoire, element – oxidare).
Să transferăm acești coeficienți la nivelul OVR și să selectăm coeficienți înaintea formulelor altor discursuri.
2 H 2 + O 2 → 2 H 2 O .
IV . Asigurarea materialului înșurubat
Dreptul de fixare a materialului:
Ce schemă de transformare a azotului este în concordanță cu această reacție similară?
4NH3 +5O2 → 4NO + 6H2O
1) N +3 → N +2 3) N +3 → N -3
2) N-3 → N-2 4) N-3 → N+2
2) Setați tipul între schimbarea etapei de oxidare a atomului Sirkişi schema de re-creare a vorbirii. Notează numerele fără spații și com.
SCHEMA PEREVOREN
A) H2S + O2 → SO2 + H2O
B) H2SO4 + Na → Na2SO4 + H2S + H2O
B) SO2 + Br2 + H2O → H2SO4 + HBr
SCHIMBAREA ETAPEI DE OXIDARE
1) E+4 → E+6
2) E+6 → E-2
3) E+6 → E+4
4) E-2 → E+6
5) E -2 → E +4 tip (521)
3) Setați tipul de tranziție între circuit și schimbați stadiul de oxidare okislyuvac la locul ei.
SCHEMA PEREVOREN
A) Cl 2 + K 2 MnO 4 → KMnO 4 + KCl
B) NH4CI + KNO3 → KCl + N2O + H2O
B) HI + FeCl 3 → FeCl 2 + HCl + I 2
ZMINA PAS
OXIDAREA OXIDULUI
1) E+6 → E+7
2) E+5 → E+1
3) E+3 → E+2
4) E 0 → E-1
5) E -1 → E 0 tip (423)
V. Ultimul cuvânt al cititorului
Reacțiile oxidative sunt combinația a două procese pe termen lung: oxidarea și reînnoirea. În aceste reacții, numărul de electroni care sunt dați oxidanților este egal cu numărul de electroni care sunt adăugați oxidanților. Întreaga lume poate fi privită ca un gigant laborator chimic, în care au loc reacții chimice, în principal reacții oxidative.
Veu . Reflecţie.
VIII . Îmbunătățirea locuinței:§ 43, ex.1, 3, 7 pag. 234-235.
Literatura Vikorystovuvan:
Nivelul de oxidare al compușilor simpli este același cu 0;
Etapa de oxidare a metalelor în Statele Unite este veche
1. Gabrielyan O.S. "Chimie. clasa a VIII-a: nav. pentru iluminare din spate. instalare -M. : Butard, 2010.
Reacții de oxid. Khomchenko G.P., Sevastyanova K.I. - Institutul de Educație, 1985.
METOARE PENTRU STUDENTI
Anexa nr. 1
Cei mai importanți oxidanți și oxidanți
|
Îndrăgostiți |
Oxigen |
|
|
Metali, N 2, vugilla, CO – dioxid de carbon (II) Săruri de H2S, S02, H2S03 HJ, HBr, HCI SnCl2, FeSO4, MnSO4, Cr2(SO4)3 HNO 2 - acid azotat NH 3 – amoniac NO - oxid de azot (II) Aldehide, alcooli, murashina și acid oxalic, Catod în timpul electrolizei |
Halogen KMnO 4, K 2 MnO 4, MnO 2, K 2 Cr 2 O 7, K2CrO4 HNO 3 -acid azotic H 2 O 2 – peroxid de apă Pro 3 – ozon, Pro 2 H2S04 (conc.), H2Se04 CuO, Ag20, PbO2 Ioni de metale nobile (Ag+, Au3+) FeCl3 Hipoclorit, clorat și perclorat „Gorka al țarului” Anod în timpul electrolizei |
|
Anexa nr. 2
Algoritm pentru plierea balanțelor chimice folosind metoda balanței electronice:
1. Schițați diagrama de reacție.
2. Semnificația etapei de oxidare a elementelor din reactanți și produși de reacție.
Tine minte!
numărul grupului acestor metale (pentrueu - III groupies).
Etapa de oxidare a atomului de oxidare în
împreună, sunați pe cel vechi - 2, cremă H2O2-1 și ОF2.
Etapa de oxidare a atomului de apă în
în legătură unul cu celălalt, sunați pe cel vechi +1, cremă MeH (hidruri).
Suma algebrică a etapelor de oxidare
elementele celor conectate sunt egale cu 0.
3. Să știți că reacția este oxidativ-hidrogen sau se desfășoară fără a modifica etapele de oxidare a elementelor.
4. Subliniați elementele a căror etapă de oxidare se modifică.
5. Variații ale proceselor electronice de oxidare și reînnoire.
6. Aceasta înseamnă ce element este oxidat (etapa de oxidare este avansată) și ce element este redus (etapa de oxidare este scăzută) în timpul procesului de reacție.
7. În partea stângă a diagramelor, indicați în spatele săgeților procesul de oxidare (înlocuirea electronilor dintr-un atom al unui element) și procesul de reînnoire (înlocuirea electronilor cu un atom al unui element).
8. În mod semnificativ oxidant și oxidant.
9. Echilibrează numărul de electroni dintre agentul de oxidare și agentul de oxidare.
10. Semnificația coeficienților pentru produșii de oxidare și degradare, produse de oxidare și reînnoire.
11. Notează coeficientul înaintea formulei de vorbire, ceea ce înseamnă partea de mijloc.
12. Verificați nivelul de reacție.
Anexa 3
Robot independent pentru verificarea cunoștințelor
Opțiunea 1
1. Indicați stadiul de oxidare a elementelor din formule, cum ar fi IBr, TeCl 4, SeF e, NF 3, CS 2.
2. În următoarele scheme de reacție, indicați stadiul de oxidare a elementului de piele și distribuția coeficientului folosind metoda echilibrului electronic:
1) F2 + Xe → XeF6 3) Na + Br2 → NaBr
2) S + H 2 → H 2 S 4) N 2 + Mg → Mg 3 N 2
Opțiunea 2
1. Setați stadiul de oxidare a elementelor în următoarele poziții: H 2 S O 4, HCN, HN O 2, PC1 3
2. Adăugați reacția echivalentă de oxidare-reînnoire:
1) CI 2 + Fe → 2) F 2 + I 2 → 3) Ca + Z → 4) Z + H 2 →
Indicați stadiul de oxidare a elementelor din produsele consumate.
Opțiunea 3
1. Indicați stadiul de oxidare al compușilor, formulele fiind XeF 4, CC 1 4, PC1 b, SnS 2.
2. Scrieţi reacţia echivalentă: a) descompunerea magneziului în descompunerea acidului sulfuric; b) interacţiunea dintre bromura de sodiu şi clor. Ce element se oxidează și care se reînnoiește?
Opțiunea 4
1. Adunați formulele pentru următoarele formule: a) nitrură de litiu (litiu cu azot); b) sulfura de aluminiu (semialuminiu si sulf); c) fluorură de fosfor, în care elementul electropozitiv prezintă stadiul de oxidare maximă.
2. Scrieţi reacţia echivalentă: a) iodură de magneziu cu brom; b) descompunerea magneziului din descompunerea acidului bromohidru. Explicați că leziunea cutanată este oxidativă și că este regenerativă.
Opțiunea 5
1. Adunați formulele pentru pașii următori: a) fluor cu xenon; b) beriliu cu carbon, în care elementul electropozitiv prezintă stadiul de oxidare maximă.
2. Determinați coeficienții folosind metoda balanței electronice pentru următoarele scheme:
1) KI + Cu(N Despre 3 ) 2 → CuI + I 2 +KN Despre 3
2) MnS+HN Despre 3 ( Sfârşit .) → MnS Despre 4 + N Despre 2 +H 2 Despre
Opțiunea 6
1. Introduceți etapele de oxidare a elementului de piele în formule, cum ar fi Na 2 S O 3, KSYu 3, NaCIO, Na 2 Cr O 4, N H 4 ClO 4, BaMn O 4.
2. Scrieţi reacţia echivalentă: a) iodură de litiu cu clorul; b) litiu cu acid clorhidric. Intrați în etapa de oxidare a tuturor elementelor și coeficienților folosind metoda echilibrului electronic.
Opțiunea 7
1. Calculați etapele de oxidare ale manganului, cromului și azotului în semiconductori, formulele fiind KMnO 4, Na 2 Cr 2 Pro 7, NH 4 N Pro 3.
2. Setați nivelul de oxidare al elementului de piele și raportul coeficienților folosind metoda echilibrului electronic în următoarele scheme:
2) H 2 S Pro 3 + I 2 + H 2 Pro → H 2 S Pro 4 + HI
Opțiunea 8
1. În ce stadiu de oxidare a carbonului în oxid de carbon (IV) și care se modifică?
Reacțiile oxidative apar înaintea celor mai largi reacții chimice și sunt de mare importanță în teorie și practică. Cele mai importante procese ale planetei sunt legate de acest tip de reacții chimice. Omenirea a fost mult timp coruptă de OVR, inițial fără a-i înțelege esența. Chiar la începutul secolului al XX-lea, a fost creată teoria electronică a proceselor oxidative. În această lecție, veți înțelege principalele puncte ale acestei teorii, metoda echilibrului electronic, veți învăța cum să formulați o serie de reacții chimice care au loc în diferite procese și veți înțelege care este mecanismul unor astfel de reacții.
Avantaj:
Vizualizare înainte:
INSTALARE ILUMINAT MUNICIPAL
ȘCOALA MEDIA MUNICIPALĂ Nr. 5 m
Lecție despre:
Reacții de oxid.
profesor de chimie: Kisakova Olga Oleksandrivna
Ipoteca inițială municipală
gimnaziu nr 5,
m. Pit-Yakh, 2010
Tema lecției: Reacții de oxid.
Meta lecție: Înțelegeți, sistematizați și extindeți cunoștințele oamenilor de știință despre reacțiile oxid-oxid, cei mai importanți produși de oxidare și produsele acestora.
Zavdannya:
- Asigurați stadiul de oxidare a elementelor, oxidare și oxidare și distribuiți coeficienții folosind metoda echilibrului electronic.
- Pentru a înțelege mai bine puterea oxid-hidroxid a reactanților, pentru a prezice produsele de reacție depinde de activitatea metalelor, de concentrația de acizi și de reacția mediului.
- Este probabil să existe o serie de reacții chimice similare cu cele găsite în diferite medii care conțin mangan.
- Arătați diversitatea și valoarea ODD în natură și viața de zi cu zi.
- Continuați pregătirea până la sfârșitul zilei cu chimie.
Progresul lecției
1. Moment organizatoric
Bună ziua! Îți voi oferi o dispoziție grozavă!
Tema lecției noastre: „Reacții oxidativ-oxidative” (Prezentare. slide 1)
Reacțiile oxidative apar înaintea celor mai largi reacții chimice și sunt de mare importanță în teorie și practică. Cele mai importante procese ale planetei sunt legate de acest tip de reacții chimice. Omenirea a fost mult timp coruptă de OVR, inițial fără a-i înțelege esența. Chiar la începutul secolului al XX-lea, a fost creată teoria electronică a proceselor oxidative. În această lecție, veți înțelege punctele principale ale acestei teorii, metoda echilibrului electronic, veți învăța să formulați o serie de reacții chimice care au loc în diferite procese și veți înțelege mecanismul de bază al unor astfel de reacții.
2. Repetarea și scuipatul materialului țesut anterior
Subiectul OVR nu este nou pentru tine, ar trebui să îl urmărești ca pe un fir prin întregul curs de chimie. Prin urmare, vă încurajez să repetați acțiunile și conceptele pe această temă.
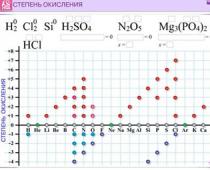
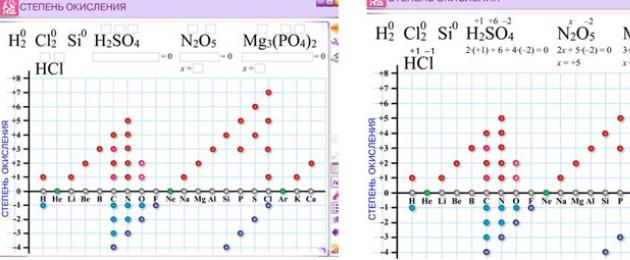
Primul aliment: „Care este stadiul de oxidare?” Fără această înțelegere, este imposibil să se determine etapele de oxidare a elementelor chimice.
/ Etapa de oxidare- aceasta este sarcina mentală a unui atom al unui element chimic, calculată pe baza unei presupuneri, astfel încât toate rezultatele să fie adunate din ioni. Etapa de oxidare poate fi pozitivă, negativă sau chiar nulă, în funcție de natura speciei.
Unele elemente trec prin etape treptate de oxidare, altele se schimbă.
De exemplu, elementelor cu un stadiu pozitiv constant de oxidare se aduc următoarele metale: Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1 , elementele actuale din grupa II a tabelului periodic:+2 , Mg +2 , Ca +2 , Sr +2 , +2 , Ra +2 , Zn +2 , precum și elementul III din grupa A - A1+3 si alte actiuni. Metalele care sunt combinate vor fi întotdeauna într-un stadiu pozitiv de oxidare.
Pentru nemetale, etapa de oxidare negativă permanentă (-1) este F.
În compușii simpli care conțin atomi de metale sau nemetale, etapa de oxidare a elementelor este zero, de exemplu: Na°, Al°, Fe°, H 2 0, 2 0, F 2 0, Cl 2 0, Br 2 0.
Etapa de oxidare caracteristică pentru apă este: +1 (H 20)-1 (NaH).
Stadiul de oxidare caracteristic pentru aciditate este: -2 (H 20), -1 (H2Pro2), +2 (OF2).
Rețineți că, în general, molecula este neutră din punct de vedere electric, prin urmare în orice moleculă suma algebrică a etapelor de oxidare este egală cu zero, iar într-un ion pliat - cu sarcina ionului.
De exemplu, extindem etapa de oxidare a cromului în dicromat de potasiu 2Cr2O7.
- Etapa de oxidare este potasiu +1, oxidare -2.
- Apreciem numărul de sarcini negative: 7. (-2) = -14
- Numărul de sarcini pozitive este + 14. Potasiul are două sarcini pozitive, iar cromul are 12.
- Deci, deoarece formula are doi atomi și crom, 12 este împărțit la doi: 12: 2 = 6.
- + 6 – aceasta este etapa de oxidare a cromului.
Verificare: suma algebrică a etapelor de oxidare pozitive și negative ale elementelor este egală cu zero, molecula este neutră din punct de vedere electric.
Robot independent nr. 1 conform fișei de instrucțiuni: urmând instrucțiunile, explorați etapele de oxidare ale elementelor în următoarele: MnO 2, H2S04, K2S03, H2S, KMnO4.
Ce înseamnă reacțiile oxidative în ceea ce privește „etapa de oxidare a elementelor chimice”? (diapozitivul 2)
/ Reacții de oxid- sunt reacții în care procesele de oxidare și reînnoire au loc simultan și, de regulă, se modifică stadiul de oxidare a elementelor.
Să aruncăm o privire asupra procesului de interacțiune dintre zinc și acid sulfuric diluat:
Când această balanță este sortată, se utilizează metoda balanței electronice. Metoda se bazează pe etape egale de oxidare a atomilor din compușii de ieșire și produșii de reacție. Principalul avantaj al adunării soldului folosind această metodă este că numărul de electroni dați poate fi egal cu numărul de electroni primiți.
- Reacțiile oxid-bază sunt acele reacții care implică transferul de electroni de la unii atomi, molecule sau ioni la alții.
- Oxidarea este procesul de renunțare la electroni, stadiul de oxidare avansează.
- Reînnoire - în timpul procesului de obținere a electronilor, etapa de oxidare scade.
- Atomii, moleculele și ionii care dau electroni se oxidează; adică zi de zi.
Atomii și moleculele care acceptă electroni se reînnoiesc; є oxidanți. - Oxidarea este întotdeauna însoțită de reînnoire, iar reînnoirea este asociată cu oxidarea.
- Reacțiile de oxid sunt combinația a două procese pe termen lung: oxidare și reînnoire.
Robot independent nr. 2 conform cardului de instrucțiuni: folosind metoda echilibrului electronic, găsiți și furnizați coeficientul în schema de reacție oxid-hidroxid în curs:
MnO 2 + H 2 SO 4 → MnSO 4 + O 2 + H 2 O (2MnO 2 + 2H 2 SO 4 → 2MnSO 4 + O 2 + 2H 2 O)
Totuși, a învăța să găsești coeficienții în OVR nu înseamnă să-i adunăm. Este necesar să se cunoască comportamentul discursurilor în OVR, să se transfere reacția, să se identifice depozitul de produse care sunt stocate în mintea reacției.
Pentru a înțelege ce elemente sunt tratate ca oxidanți și care sunt degenerative, trebuie să ne întoarcem la sistemul periodic al lui D.I. Dacă vorbim despre cuvinte simple, atunci cele mai importante autorități pot fi atașate acestor elemente, care au o rază atomică mai mare decât altele și un număr mic (1-3) de electroni în nivelul actual de energie i. De aceea, mirosurile pot fi ușor cauzate de ele. Acest lucru a fost important. Cele mai puternice autorități moderne le folosesc pentru extragerea metalelor de luncă și luncă-pământ, dizolvate în principalele subgrupe ale grupelor I și II (de exemplu, sodiu, potasiu, calciu etc.).
Cele mai tipice nemetale, care au o structură aproape completă a sferei electronice externe și au o rază atomică semnificativ mai mică decât metalele din aceeași perioadă, pot accepta cu ușurință electroni și sunt implicate în reacții bazate pe oxidare, cum ar fi oxidarea vachi. Cei mai puternici agenți oxidanți sunt elementele ușoare ale subgrupelor de cap VI - VII, cum ar fi fluorul, clorul, bromul, acru, sulful etc.
În același timp, trebuie să ne amintim că am împărțit substanțele simple în materiale oxidante și oxidante la fel de clar precum le-am împărțit în metale și nemetale. Dacă nu consumă metal, unde este un agent oxidant puternic, toate pot dezvălui puteri puternice. Elementele aflate în diferite stadii de oxidare se pot comporta diferit.
Deoarece un element se află într-o stare mai mare de oxidare, acesta poate deveni mai oxidat. De exemplu, la HN+5 O 3 azotul + 5 poate fi doar oxidat și acceptă electroni.
Doar originalul poate fi un element care se găsește în lumea inferioară a oxidării. De exemplu, N-3 N 3 azotul poate -3 poate da electroni, atunci. este o excursie de o zi.
Elementele din etapele intermediare de oxidare pozitivă pot să dea și să accepte electroni și, prin urmare, să acționeze ca agenți de oxidare. De exemplu, N+3, S +4 . Consumând în mijlocul unui agent oxidant puternic, se comportă ca margaretele. Și, apropo, în mijlocul principal, duhoarea tinde să fie oxidantă.
Pe baza puterilor oxidative-primare, discursurile pot fi împărțite în trei grupe:
- oxidanţi
- vidnovniki
- oxidanți – oxidanți
Robot independent nr. 3 cu o hartă instrucțională: fiecare dintre schemele de ghidare are un nivel cu reacția MnO 2
- 2MnO 2 + O 2 + 4KOH = 2K 2 MnO 4 + 2H 2 O (MnO 2 -jurnal)
- MnO 2 + 4HCI = MnCl 2 + CI 2 + 2H 2 O (MnO 2 - agent de oxidare)
3. Cunoștințe pierdute și extinse
Cele mai importante produse oxidative și actualizate
1. Acid sircanic – N 2 SO 4 є oxidant
A) Relația dintre zinc și H diluat 2 SO 4 (diapozitivul 3)
Care ion este oxidat în această reacție? (H+ )
Produsul este reînnoit cu metal, care se află într-un interval de tensiune până la apă, є H 2 .
B) Să ne uităm la o altă reacție - interacțiunea zincului cu H concentrat 2 SO 4 (diapozitivul 4)
Cum modifică atomii stadiul de oxidare? (zinc și sirka)
Acidul sulfuric concentrat (98%) se amestecă cu 2% apă și se dizolvă ușor. De fapt, ionii sulfat sunt cei care iau parte la reacție. Produsul reînnoirii este Sirkvoden.
Depinde de activitatea produselor metalice din H concentrat reînnoit 2 SO 4 diferit: H2S, S, SO2.
2. Un alt acid – nitric – oxidează și nitratul – NO ion 3 - . Proprietățile oxidative ale nitratului - ion de substanță semnificativă pentru ionul H+ Ionul de apă nu este redus la un atom, așa că atunci când acidul azotic reacționează cu metalele, nu se vede apă, ci se creează un amestec de azot. Aceasta depinde de concentrația acidului și de activitatea metalului. Acidul azotic diluat este mai concentrat, mai puțin concentrat (pentru același metal) (diapozitivul 6)
În diagrame sunt indicate produse, în locul cărora există gama maximă de produse acide posibile
Aurul și platina nu reacționează cu HNO 3 , dar aceste metale sunt dezintegrate în „turturele regale” - un amestec de acizi clorhidric și azot concentrați într-un amestec de 3:1.
Au + 3HCI (Conc.) + HNO3 (Conc.) = AuCI3 + NO + 2H2O
3. Cel mai puternic agent oxidant dintre compușii simpli este fluorul. Trebuie să fie activ și este important să arate bine. Prin urmare, în laboratoare, cum se oxidează vikorystpermanganat de potasiu KMnO 4 . Proprietățile sale oxidative depind de concentrație, temperatură și mediu.
Crearea unei situații problematice:Înainte de curs, am pregătit permanganat de potasiu („mangan”), am vărsat o sticlă de vin și mi-am stricat halatul chimic preferat. Propuneți (după ce ați completat dovezile de laborator) discursul, care vă va ajuta să curățați halatul.
Reacțiile de oxidare-reducere pot apărea în diferite medii. Natura reacției dintre aceste substanțe se poate schimba și ea: fluidul mijlociu infuzează o modificare a etapelor de oxidare a atomilor.
Pentru a crea un mediu acid, adăugați acid sulfuric. Sarea și azotul trebuie să stagneze mai devreme, pentru că primul este gata să se oxideze, iar celălalt în sine esteputernic oxidant și poate provoca procese secundare. Pentru a crea un amestec de pajiște, combinați hidroxid de potasiu sau sodiu sau apă neutră.
Dovezi de laborator:(reguli TB)
În mai multe eprubete numerotate se toarnă 1-2 ml de permanganat de potasiu diluat. Adăugați o picătură de acid sulfuric în prima eprubetă, adăugați apă în a treia eprubetă, hidroxid de potasiu în a treia eprubetă, umpleți a patra eprubetă ca control. Apoi adăugați sulfit de sodiu în primele trei eprubete, cu grijă. Semnifica. Cum se schimbă pregătirea probei de piele. (Diapozitivul 7, 8)
Rezultate de laborator:
Produse de reînnoire KMnO 4 (MnO4 -):
- în mijlocul acru - Mn+2 (Sil), rozchin fără bare;
- în mijlocul neutru - MnO 2, asediu de furtună;
- la centrul de luncă - MnO 4 2- culoare verde rozchin. (Diapozitivul 9,)
Înainte de scheme de reacție:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + KOH → Na 2 SO 4 + K 2 MnO 4 + H 2 O
Selectați coeficienți pentru balanța dumneavoastră electronică suplimentară. Spuneți oxidarea și ziua (diapozitivul 10)
(Sarcina este diferită: oamenii de știință puternici notează produsele de reacție în mod independent)
(diapozitivul 11)
Dacă ați completat dovezile de laborator, completați discursul, care vă va ajuta să curățați halatul.
Dovezi demonstrative:
Soluția de permanganat de potasiu poate fi îndepărtată cu ușurință prin soluția de peroxid de apă, acidulată cu acid otic:
2KMnO 4 + 9H 2 O 2 + 6CH 3 COOH = 2Mn(CH 3 COO) 2 + 2CH 3 COOK + 7O 2 + 12H 2 O
Când folosim permanganat de potasiu pentru a înlocui oxidul de mangan (IV), suferim o altă reacție:
MnO 2 + 3H 2 O 2 + 2CH 3 COOH = Mn(CH 3 COO) 2 + 2O 2 + 4H 2 O (diapozitivul 12)
După îndepărtarea petelor, bucățile de țesătură trebuie clătite cu apă.
Semnificația reacțiilor de oxid
Într-o lecție este imposibil să examinăm toate tipurile diferite de reacții ale oxidului. Este important să se reevalueze importanța lor în chimie, tehnologie și viața de zi cu zi.
Învăța: Reacțiile de oxid stau la baza separării metalelor și aliajelor, apei și halogenilor, pajiștilor și medicamentelor.
Funcționarea membranelor biologice și multe procese naturale sunt asociate cu reacții oxidative: fermentație, fermentație și fotosinteză. Fără a înțelege esența și mecanismele reacțiilor oxidative, este imposibil de înțeles activitatea reactoarelor chimice (acumulatoare și baterii), îndepărtarea acoperirilor uscate și prelucrarea magistrală a suprafețelor metalice ale particulelor.
În scopul dezinfectării și dezinfectării, utilizați proprietățile oxidative ale unor substanțe obișnuite precum peroxidul de apă, permanganatul de potasiu, clorul și clorul, sau mai mult clor.
Clorul, ca agent oxidant puternic, este folosit pentru sterilizarea apei curate și decontaminarea apelor uzate.
4. Asigurarea materialului înșurubat
Test:
- Mijlocul acid are KMnO 4 actualizat la:
- sare Mn +2
- MnO2
- K2MnO4
- H concentrat 2 SO 4
- HNO concentrat 3 nu reactioneaza cu metalul:
- Se diluează HNO3
- N2O
- Care este produsul reînnoirii KMnO? 4 lipsesc: 2KMnO 4 + 3K 2 SO 3 + H 2 O = + 3K 2 SO 4 + 2KOH
- MnO2
- 2MnSO4
- K2MnO4
(verificarea reciprocă a testelor în perechi)
5. Grădinărit acasă
Pentru schemele vicoristice date în lecție, completați egalizarea reacției și distribuiți coeficienții în ele folosind metoda balanței electronice:
- AI + H2S04 (conc.) →
- Ag + HNO3 (conc.) →
- KBr + KMnO 4 + H 2 SO 4 → …….. + Br 2 + K 2 SO 4 + H 2 O (diapozitivul 13)
6. Prezentarea pungilor la lecție
Fișă de instrucție
I. Repetarea și consolidarea materialului învățat anterior
Zavdannya 1: Extindeți etapele de oxidare a elementelor în următoarele:
MnO2, H2SO4, K2SO3, H2S, KMnO4.
Zavdannya 2: Folosind metoda echilibrului electronic, aflați și furnizați coeficienții din schema de reacție a oxidului direct:
MnO2 + H2SO4 → MnS04 + O2 + H2O
Zavdannya 3: În oricare dintre scheme, reacția MnO 2 arată puterea unui oxidant, iar acesta arată puterea unui lider:
A) 2MnO 2 + O 2 + 4KOH = 2K 2 MnO 4 + 2H 2 O B) MnO 2 + 4HCI = MnCI 2 + CI 2 + 2H 2 O
II. Pogliblennya și cunoștințe extinse:
Dovezi de laborator: (urmați regulile TB)
În mai multe eprubete numerotate se toarnă 1-2 ml de permanganat de potasiu diluat. Adăugați o picătură de acid sulfuric în prima eprubetă, apă în a treia, hidroxid de potasiu în a treia și umpleți a patra eprubetă cu controlul. Apoi adăugați sulfit de sodiu în primele trei eprubete, cu grijă.
Aflați cum se modifică prepararea amestecului în proba de piele:
1 eprubetă -
2 tuburi -
3 tuburi -
4 tuburi - control
Zavdannya: Înainte de scheme de reacție:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + KOH → Na 2 SO 4 + K 2 MnO 4 + H 2 O
Selectați coeficienți pentru balanța dumneavoastră electronică suplimentară. Spune oxidare și oxidare.
III. Asigurarea materialului înșurubat
Test:
1. Mijlocul acid este KMnO 4 actualizat la:
A) sare Mn +2 B) MnO 2 C) K 2 MnO 4
2. H concentrat 2 SO 4 la temperatura initiala este pasiva:
A) Zn B) Cu C) AI
3.HNO concentrat 3 nu reactioneaza cu metalul:
A) Ca B) Au C) Mg
4.Diluat cu HNO 3 cu metale active upgrade la:
A) NU B) N 2 C) N 2 O
5. Care este produsul reînnoirii KMnO? 4 lipsesc:
2KMnO 4 + 3K 2 SO 3 + H 2 O = + 3K 2 SO 4 + 2KOH
A) MnO 2 B) 2MnSO 4 C) K 2 MnO 4
Scor pentru test (pe baza rezultatelor verificării încrucișate)
IV. Îmbunătățirea locuinței
Schemele vikoriste, prezentate în lecție, completează evaluarea reacției și distribuția coeficienților în ele:
1. AI + H2S04 (conc.) →
2. Ag + HNO3 (conc.) →
3. KBr + KMnO 4 + H 2 SO 4 → …….. + Br 2 + K 2 SO 4 + H 2 O
Prezentarea lecției (notele lecției)
Iluminat principal
Linia de materiale didactice a lui O. S. Gabrielyan. Chimie (8-9)
Respect! Administrația site-ului nu este responsabilă pentru înlocuirea dezvoltărilor metodice, precum și pentru coerența dezvoltării Standardului Educațional Federal de Stat.
Literatura Wikorystan:
- O carte de referință pentru un profesor de chimie. clasa a 8-a O.S. Gabrielyan, N.P. Voskoboynikova, A.V. 2003r.
- EFU Chimie clasa a VIII-a. O.S. Gabrielyan, (M.: Dropia).
- Muncitorul se uită la asistentul O.S. Gabrielyana Chimie clasa a VIII-a. O.S. Gabrielyan, A.S. Solodkov (M.: Butard-2013).
Obiectivele lecției:
- la inceput: aflați despre noua clasificare a reacțiilor chimice bazată pe schimbarea etapelor de oxidare a elementelor - reacții oxidative-noi, repetați conceptele de „oxidant”, „oxidant”, „oxidare”, dnovlennya”;
- în curs de dezvoltare: continua dezvoltarea gândirii logice, modelarea interesului într-un subiect, cercetare și tehnologii moderne.
- vykhovny: formulați o viziune științifică asupra lumii a oamenilor de știință, formulați o cultură a colaborării inter-sociale: evaluați-vă munca.
Zasobi navchannya:
- Program electronic pentru profesorul „Chimie clasa a VIII-a”. O.S. Gabrielyan, (M.: Dropia).
- Ghid de bază interactiv „CHIMIA VIZIALA. Chimie. 8-9 clase Moscova: SRL „Ispit-Media” 2011-2013
Pidruchnik: EFU Gabrielyan O.S. Chimie.Clasa a VIII-a: - M.: Dropia, 2015
Progresul lecției
1. Etapa organizatorică
Pregătirea elevilor pentru lucrul la clasă. Reguli pentru roboți și televizor în clasa inteligentă atunci când lucrați cu laptopuri
2. Actualizarea cunoștințelor academice
A) Cu toții cunoaștem clasificarea reacțiilor chimice și semnele care stau la baza clasificării pielii. Repeta. „Tipuri de reacții chimice” (în special navchannya 2)
Lucrare de literatură 1:
1. În funcție de tipul și tipul de vorbire care reacționează și este creat, există reacții:
a) racordare;
b) desfăşurare;
c) substituţie;
d) schimb (reacție chirurgicală și de neutralizare).
2. În spatele trenului de agregate, reacțiile (fazele) se separă:
a) omogen;
b) eterogen.
3. În urma efectului termic, reacțiile se împart în:
a) exotermă (reacție inflamabilă);
b) endotermic.
4. Se observă reacțiile catalizatorului:
a) catalitice (inclusiv enzimatice);
b) necatalitic.
5. Reacțiile sunt direct diferențiate:
a) vârcolaci;
b) irevocabil.
B) Dați o descriere suplimentară a reacției de sinteză a oxidului de sulf (6) cu oxidul de sulf (4) și acid:
3. Dobândirea de noi cunoștințe de la EFU
A) Zgadaymo, ce este S.O. Și cum se schimbă pentru XP. (Repetați cu inversarea treptată, în special începutul 2.)

B) Explicația materialului din EFU latură 263–265.


V) Lucrați cu suplimentul electronic EFU.

D) Lucrări din literatură 2

4. Cunoștințe primare
A)Învață să faci o moștenire. SUPLIMENT ELECTRONIC

La răsucirea laturii vikoriste. 264-265 EFZ.
B) Lucrarea se bazează pe adăugarea electronică, descoperirea oxidantului, oxidantului, transferul de electroni, munca tablei albe.
Oleksandrova Anfisa Mihailivna
Profesor de chimie
Instituția de învățământ municipal „Școala secundară Privolzka” districtul Volzky RME
Subiect: „Reacții oxid-oxid”
Tip de lecție: lecție – întărirea și repetarea materialului din învățarea lucrului frontal, pereche și individual al elevilor.
Uită-te la lecție- Explicativ și ilustrativ.
Aplica metode si metode. Verbal-în primul rând și demonstrativ-practic. Muncă independentă de la găsirea dovezilor corecte, discuții despre tipul selectat, dovezi de laborator din nivelul actual al reacțiilor scrise, discuții despre rezultatele muncii.
Scop: Podgliblennya cunoștințe shodo pliat metoda Rivnyan OVR de echilibru electronic.
Instrucțiuni pentru lecție:
Osvitny: repetați conceptele de bază despre procesele de oxidare și reînnoire, stadiul de oxidare, oxidare și oxidare, luați în considerare esența reacțiilor de oxidare, rezumați formarea reacțiilor chimice Acest proces are loc în diverse medii folosind metoda echilibrului electronic.
În curs de dezvoltare: acceptă dezvoltarea și dezvoltarea interesului cognitiv al elevilor pentru subiect, acceptă dezvoltarea gândirii elevilor, analizează formarea și dezvoltarea cunoștințelor pe tema.
Vikhovny: să dezvolte nevoi informate de la oameni cunoscători, să asculte cu atenție gândurile fiecărui membru al echipei.
Reactivi: dizolva permanganat de potasiu, acid sulfuric, sulfit de sodiu, apa.
Echipament: eprubete, pipete.
Planul lecției:
I. Actualizarea cunoștințelor.
V. Tema pentru acasă.
VI. Reflecție și susținere a genților.
Motto-ul lecției: „Cine vrea să cheltuiască, dar cine vrea să știe...”
I. Actualizarea cunoștințelor.
Rozmova înainte ca materialul să fie țesut.
1) Ce reacții se numesc reacții oxidative?
Reacțiile oxidative sunt reacții care implică transferul de electroni de la unii atomi, molecule și ioni la alții.
2) Care este procesul de oxidare?
Oxidarea este procesul de renunțare la electroni, stadiul de oxidare avansează.
3) Ce proces se numește reînnoire?
Reînnoirea este procesul de câștig de electroni, iar etapa de oxidare scade.
4) Cum se numesc particulele care alcătuiesc electronii?
Atomii, moleculele și ionii care dau electroni se oxidează; adică zi de zi.
5) Cum se numesc particulele care captează electronii?
Atomii și moleculele care acceptă electroni se reînnoiesc; є oxidanți.
6) Ce este „etapa de oxidare”?
Etapa de oxidare este sarcina mentală a unui atom dintr-o moleculă, presupunând că molecula este compusă din ioni și este în general electroneutră (sarcina mentală a unui atom, pe care i-o atribuim atunci când primește electroni).
7) Ce metodă de pliere a reacțiilor oxid-oxid cunoașteți? Ce regulă stă la baza acestui lucru?
Muncă independentă de a studia la școală cu carduri (cum s-a discutat).
1. Stadiul de valență și oxidare a elementelor în etapele următoare sunt:
CH4, CI2, CO2, NH3, C2H4, CH3COOH, V2O5, Na2B4O7, KCl04, K2HP04, Na2Cr2O7.
Sugestie: Pentru vrăjitorie, puteți utiliza programul 1.
IV III III III
W -4 N +1 4 , Cl 0 2, C +4 Pro -2 2, N -3 H +1 3, C -2 2 H +1 4, C -3 H +1 3 C +3 O -2 O -2 H +1, V +5 2 O -2 5 ,
I VII II I I V II I VI II
K+1CI+70-24, K+12H+1P+5O-24Na+12Cr+620-27.
2. În care dintre inducții nivelul inferior al reacției MnO 2 indică puterea oxidantului și în care dintre ele arată puterea oxidantului?
A ) 2Mn02 + 2H2S04 2MnS04 + O2 + 2H20;
b ) 2Mn02 + O2 + 4KOH 2K2Mn04 + 2H20;
V ) Mn02 + H2 = MnO + H20;
G ) 2MnO 2 + 3NaBiO 3 + 6HNO 3 = 2HMnO 4 + 3BiONO 3 + 3NaNO 3 + 2H 2 O
Subiect:
Oxidantul acceptă electroni și, ca urmare, stadiul de oxidare scade, prin urmare, în toamnă. Aі V MnO2 este oxidant. Reactorul eliberează electroni și, ca urmare, stadiul de oxidare avansează, prin urmare, la picături bі G MnO 2 este strămoșul.
II. Motivația și stabilirea obiectivelor.
Reacțiile de oxid sunt extrem de ample. Cu acestea sunt asociate, de exemplu, procesele de metabolism și metabolism care au loc într-un organism viu, putrezirea și fermentația, fotosinteza. Procesele oxid-apă însoțesc circulația râurilor în natură. Ele pot fi evitate în timpul incendiilor, în timpul proceselor de coroziune a metalelor, în timpul electrolizei și topirii metalelor. Ele vor ajuta la eliminarea umezelii și a acizilor, precum și a multor alte produse valoroase. Reacțiile de oxid stau la baza conversiei energiei chimice în energie electrică în celulele galvanice și de ardere.
Problemă: Înainte de oră, am pregătit permanganat de potasiu („mangan”), am vărsat o sticlă de gunoi și mi-am stricat iubitul halat chimic Propune (după ce am completat dovezile de laborator) o declarație care poate fi folosită pentru a curăța halatul.
III. Exersarea și extinderea cunoștințelor.
Reacțiile de oxidare-reducere pot apărea în diferite medii. Natura reacției dintre aceste substanțe se poate modifica și ea: fluidul mijlociu infuzează o modificare a etapelor de oxidare a atomilor.
Pentru a crea un mediu acid, adăugați acid sulfuric. Sarea și azotul trebuie să stagneze mai devreme, pentru că Primul este predispus la oxidare, iar celălalt în sine este foarte oxidant și poate provoca procese secundare. Pentru a crea un amestec de pajiște, combinați hidroxid de potasiu sau sodiu sau apă neutră.
Dovezi de laborator: (reguli TB)
În mai multe eprubete numerotate se toarnă 1-2 ml de permanganat de potasiu diluat. Adăugați o picătură de acid sulfuric în prima eprubetă, adăugați apă în a treia eprubetă, hidroxid de potasiu în a treia eprubetă, umpleți a patra eprubetă ca control. Apoi adăugați sulfit de sodiu în primele trei eprubete, cu grijă. Vă rugăm să rețineți cum se modifică preparatul în proba de piele.
Rezultate de laborator:
Produse de reînnoire KMnO 4 (MnO4 -):
pentru mijlocul acru – Mn +2 (sil), fără hambar;
în mijloc neutru - sediment de furtună de MnO 2;
în mijlocul pajiștii - MnO 4 2 - culoare verde.
Zavdannya . Date schema de reacție:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + KOH → K 2 MnO 4 + Na 2 SO 4 + H 2 O
Sarcina este diferită: oamenii de știință puternici notează produsele de reacție în mod independent:
KMnO4 + Na2S03 + H2SO4 →
KMnO4 + Na2S03 + H20 →
KMnO4 + Na2SO3 + KOH →
Selectați coeficienții folosind metoda echilibrului electronic folosind algoritmul (Anexa 1). Spune oxidare și oxidare.
Subiect:
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 → 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
2KMnO 4 + 3Na 2 SO 3 + H 2 O → 2MnO 2 ↓ + 3Na 2 SO 4 + 2KOH
2KMnO 4 + Na 2 SO 3 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O
Dacă ați completat dovezile de laborator, completați discursul, care vă va ajuta să curățați halatul.
Produșii de reacție sunt prezentați în diagramele de mai jos. Specificați reactivii, adăugați ecuația de reacție și utilizați metoda echilibrului electronic:
(învață să exersezi în perechi)
a) KI + KMnO 4 +. . . ->MnSO 4 + I 2 + K 2 SO 4 + H2O
Dovezi: deoarece reacția are ca rezultat eliberarea de Mn +2, procesul se desfășoară într-un mediu acid cu participarea acidului sulfuric și se formează sulfat de potasiu.
10KI + 2 KMnO 4 + 8H 2 SO 4 = 2MnSO 4 + 5I 2 + 6K 2 SO 4 +8H 2 O
2I -1 -2e -> I 2 0 5 - oxidare, oxidare
Mn +7 + 5e -> Mn +2 2- reînnoire, oxidare
b ) NaI + KMnO 4 + . . . -> I 2 + K 2 MnO 4 + NaOH
Dovezi: deoarece în urma reacției iese K 2 MnO 4 și procesul se desfășoară în mijlocul potrivit cu participarea hidroxidului de potasiu
2NaI + 2 KMnO 4 + 2KOH = I 2 + 2K 2 MnO 4 + 2NaOH
2I -1 -2e -> I 2 0 1- oxidare, zi
Mn +7 + 1e -> Mn +6 2- reînnoire, oxidare
V ). . . + KMn04 + H20 -> NaN03 + Mn02 + KOH
Dovezi: în această reacție de oxidare a volumelor de KMnO 4, este ușor să presupunem că nitritul de sodiu este transformat în nitrat de sodiu, unde N +3 în nitrat:
3 NaNO 2 + 2 KMnO 4 + H 2 O = 3NaNO 3 + 2MnO 2 + 2KOH,
N +3 - 2e -> N +5 3 - oxidare, oxidare
Mn +7 + 3e -> Mn +4 2 - reînnoire, oxidare
Pe lângă permanganatul de potasiu, alte cuvinte pot avea un efect oxidativ. Puteți afla mai multe despre ele din Addendumul 2.
1) H2SO4 (diluat), oxidat H+1
Produsul este actualizat cu metal, care se află la o gamă de tensiuni până la apă, - H2.
De exemplu,
H2SO4 (nerupt) + Zn -> ZnSO4 + H2
H2SO4 (dizolvat) + Cu nu reacţionează.
2) H2S04 (concentrat), agent de oxidare S +6
Depinde de activitatea produselor metalice de H concentrat 2SO4 diferit: H2S; S; SO 2 . Produsul de reînnoire rămâne și el în concentrație acizi (tabelul 18 pagina 250 din manual).
3) oxidant HNO3 N +5 (Tabelul 18 pagina 250 din manual).
HNO concentrat 3 Metale pasive precum Fe, Cr, Al, care se datorează formării unei topituri subțiri sau foarte groase de oxid pe suprafața acestor metale.
Au și Pt nu reacționează cu HNO 3, dar aceste metale sunt separate în „turturele regale” - un amestec de acizi clorhidric și azot concentrați într-un raport de 3: 1.
De exemplu:
Au + 3HCl (Conc.) + HNO3 (Conc.) = AuCl3 + NO + 2H2O.
4) Până la 2 C r 2 O 7 într-un mediu acid este reînnoit la Cr 3+
în mediu neutru până la Cr 2 O 3
în luncă seredovișche până la CrO 4 2-
Reacțiile de oxid în chimia organică sunt asociate fie cu formarea de legături acide, fie cu separarea apei.
Regula pentru realizarea conexiunilor: - ВІН → -1е
Pro → -2e
scindarea a 1 atom H → -1е
eu V. Consolidarea materialului cercetat.
Pentru a consolida materialul acoperit, trec testele.
Opțiunea 1
1. Care nemetal este un oxidant puternic?
1) fluor 2) sirka 3) ozon 4) siliciu
2. Etapa de oxidare a sulfului din sulfatul de potasiu este mai veche
1)+6 2)+4 3)0 4)-2
3. În orice reacție, atomul de clor joacă rolul unui părinte
1) Cu + Cl 2 = CuCl 2
2) HCl + NaOH = NaCI + H2O
3) HCl + MnO2 = MnCl2 + CI2 + H2O
4) CI2 + H2 = HCI
5) +2 → 0
6) 0 → - 1
5. Metoda Vikorist de balanță electronică pentru egalizarea reacției:
PbS + H2O2 →PbS04 + H2O
6. Metoda Vikorist de echilibru electronic egalizează reacția:
KBr + KMnO 4 + H 2 SO 4 → …….. + Br 2 + K 2 SO 4 + H 2 O
Viznachte okislyuvach ta vidnovnik.
Tip: 1-1; 2-1; 3-3; 4-A3, B4, B2, G5.
Opțiunea 2
1. În orice soluție supraexpusă, atomul de sulf se află în stadiul de oxidare +6
1) FeSO 3 2) S 3) SO 2 4) Până la 2 SO 4
2. Care element este reînnoit în reacția Fe2O3+CO=Fe+СО2
1) zalizo 2) kisen 3) cărbune
3. Selectați nivelul de reacție în care elementul de carbon este oxidat.
1)2 C + O 2 = 2CO
2) CO2 + 2Mg = 2MgO + C
3) CH4 + 2O2 = CO2 + 2H2O
4) C + 2H 2 SO 4 = CO 2 + 2H 2 O + 2SO 2
4. Setați consistența dintre reacții și modificați etapa de oxidare a agentului de oxidare în această reacție:
Reacție comparativă Modificarea etapei de oxidare a oxidantului
A) SO 2 + N O 2 = SO 3 + NO 1) -1 → 0
B) 2NH 3 + 2Na = 2NaNH 2 + H 2 2) 0 → -2
B) 4N O 2 + O 2 + 2H 2 O = 4HN O 3 3) +4 → +2
D) 4NH 3 + 6NO = 5N 2 + 6H 2 Pro 4) +1 → 0
5) +2 → 0
6) 0 → - 1
5. Metoda Vikorist de echilibru electronic, adunați reacția:
NaNO2 + NH4CI → NaCI + 2H2O + N2
Viznachte okislyuvach ta vidnovnik.
6. Metoda Vikorist de echilibru electronic, adunați reacția:
KI+H 2 ASA DE 4 + NaNO 2 → …… + K 2 ASA DE 4 +Na 2 ASA DE 4 + NU + H 2 O
Viznachte okislyuvach ta vidnovnik.
Tip: 1-4; 2-1; 3-2; 4-A3, B4, B2, G5.
V. Tema pentru acasă.
1. Adăugați reacția egală și distribuția coeficienților pentru cealaltă metodă de echilibrare electronică:
1. K 2 Cr 2 O 7 + KNO 2 + …….→ KNO 3 + Cr 2 (SO 4 ) 3 + …..+H 2 O
2. C 6 H 5 -CH 3 + KMnO 4 + H 2 SO 4 → C 6 H 5 COOH +….+….+…..
3. 3 2 H 5 OH + K 2 Cr 2 O 7 + H 2 SO 4 → CH 3 COOH +….+….+…..
4.Na 2 SO 3 + Până la 2 Cr 2 O 7 + H 2 SO 4 → ….+….+….+…..
2. Combinați oxidarea formaldehidei cu permanganatul de potasiu, acidulat cu acid sulfuric, astfel încât formaldehida să fie oxidată la coeficienți CO 2, selectați metoda echilibrului electronic. 2
împreună, sunați pe cel vechi - 2, cremă H2O2-1 și ОF2.
4. Etapa de oxidare a atomului de apă în
în legătură unul cu celălalt, sunați pe cel vechi +1, cremă MeH (hidruri).
5. Suma algebrică a etapelor de oxidare
elementele celor conectate sunt egale cu 0.
Etapa de oxidare
Puterea discursurilor pe bază de oxid
Tipuri de reacții de oxidare-reînnoire
Reacții direct oxid-oxid
Reacțiile oxidative le includ pe cele care sunt însoțite de mișcarea electronilor de la o particulă la alta. Când ne uităm la tiparele reacțiilor oxidative noi, conceptul de etapă de oxidare devine clar.
1. Etapa de oxidare
Concept etapa de oxidare introdus pentru a caracteriza starea elementelor în conexiuni. Sub etapa de oxidare se înțelege sarcina mentală a unui atom din subsol, calcule care provin din ipoteza că concatenarea este formată din ioni. Etapa de oxidare este indicată printr-un număr arab cu semnul plus când electronii sunt deplasați de la un atom dat la un alt atom și printr-un număr cu semnul minus când electronii sunt deplasați din direcția de întoarcere. Plasați numărul з cu semnul „+” sau „-” deasupra simbolului elementului. Etapa de oxidare indică starea de oxidare a atomului și este o formă simplă de transfer de electroni: nu există nicio urmă a încărcăturii efective a atomului din moleculă (de exemplu, în molecula LiF sarcinile efective ale Li și F). sunt egale cu fiabile + 0,89 și -0,89 , atunci etapa de oxidare este +1 și -1), nu valența elementului (de exemplu, în compușii CH 4, CH 3 OH, HCOOH, CO 2, valența elementului carbonul este 4, iar etapa de oxidare este similară cu -4, -2, + 2, +4). Valorile numerice ale etapei de valență și oxidare pot fi reduse în valoare absolută chiar și atunci când se creează structura ionică.
Când este selectată etapa de oxidare, se aplică următoarele reguli:
Atomii elementelor care se găsesc în sălbăticie sau sub formă de molecule de substanțe simple au o etapă de oxidare egală cu zero, de exemplu Fe, Cu, H 2, N 2 etc.
Etapa de oxidare a elementului sub forma unui ion monoatomic din subunitate, care formează un ion bodov, este similară cu sarcina acestui ion,
1 -1 +2 -2 +3 -1
de exemplu, NaCI, Cu S, AlF3.
Majoritatea apei are o etapă de oxidare de +1, urmată de hidruri metalice (NaH, LiH), care au o etapă de oxidare de -1.
Cea mai extinsă etapă a oxidării acide este -2, după peroxizi (Na 2 O 2, H 2 O 2), în care stadiul oxidării acide este -1 și F 2 O, în care stadiul oxidării acide este +2 .
Pentru elementele cu o etapă de oxidare instabilă, valorile acestora pot fi descompuse prin cunoașterea formulei combinației, astfel încât suma algebrică a etapelor de oxidare a tuturor elementelor dintr-o moleculă neutră să fie egală cu zero. Într-un ion pliabil, această cantitate este egală cu sarcina ionului. De exemplu, etapa de oxidare a atomului de clor din molecula de HClO4 este calculată din sarcina totală a moleculei = 0, unde x este stadiul de oxidare a atomului de clor) și +7. Etapa de oxidare a atomului de sulf din ionul (SO 4) este 2-[x + 4(-2) = -2] +6.
2. Puterea discursurilor pe bază de oxid
Orice reacție oxidativă constă în procese de oxidare și reînnoire. Oxidare - Acesta este procesul de a da electroni de către un atom, ion sau moleculă unui reactiv. Discursuri pe care le țin electronii lor sunt oxidați în timpul procesului de reacție vidnovnikami.
Reînnoirea este procesul de acceptare a electronilor de către un atom, reactiv ion sau moleculă.
Discursurile care acceptă electroni și prin aceasta se regenerează sunt numite oxidanți.
Reacțiile de oxidare-reînnoire apar întotdeauna ca un singur proces numit reacție de oxid. De exemplu, în timpul interacțiunii metalului zinc cu ionii de cupru. jurnal(Zn) renunță la electroni oxida– ioni de cupru (Cu 2+):
Zn + Cu 2+ Zn 2+ + Cu
Cuprul este vizibil pe suprafața zincului și se transferă la zinc la margini.
Puterile oxidativ-relative ale elementelor sunt asociate cu durata de viata a atomilor lor si sunt determinate de prevederile sistemului periodic D.I. Mendelev. Unicitatea elementului se datorează legăturii slabe a electronilor de valență din nucleu. Atomii metalelor, pentru a atinge nivelul actual de energie, au un număr mic de electroni similar cu ieșirea lor, deci. sunt ușor de oxidat, jucând rolul de oxidanți. Cele mai puternice metale sunt cele mai active metale.
Criteriul pentru activitatea oxidativă a elementelor poate fi valoarea acestora electronegativitate evidentă: cu cât este mai mare, cu atât se exprimă mai puternic activitatea oxidativă a elementului, iar cu cât este mai mică, cu atât mai clar se manifestă activitatea sa oxidativă. Atomii nemetalelor (de exemplu, F, O) au o valoare mare a densității electronilor și electronegativitate mare, acceptă cu ușurință electronii, atunci. є oxidanți.
Puterea pe bază de oxizi a elementului se află în stadiul oxidării sale. Același element este separat stadiile inferioare, superioare și intermediare de oxidare.
Ca un fund, să ne uităm la sirku S și її її їлуки H 2 S, SO 2 și SO 3. Legătura dintre structura electronică a atomului de sulf și puterile sale oxidativ-primare în aceste cazuri se bazează pe reprezentările științifice din Tabelul 3.1.
În molecula de H 2 S, atomul de sulf are o configurație stabilă de octet a nivelului de energie externă 3s 2 3p 6 și, prin urmare, nu mai poate accepta electroni, sau altfel îi poate oferi.
Starea atomului din care pot fi acceptați cei mai mulți electroni se numește stadiul de oxidare cel mai scăzut.
La nivelul inferior de oxidare, atomul își pierde proprietățile oxidative și poate deveni doar o sursă.
Tabelul 1.
|
Formula de vorbire |
Formula electronica |
Autorități pe bază de oxid |
|
|
|
1s 2 2s 2 2p 6 3s 2 3p 6 |
|
|
|
|
1s 2 2s 2 2p 6 3s 2 3p 4 |
oxidant |
jurnal |
|
|
1s 2 2s 2 2p 6 3s 2 3p o |
oxidant |
|
|
|
1s 2 2s 2 2p 6 3s sau 3p 0 |
oxidant |
|
În molecula de SO 3, toți electronii externi ai atomului Sir sunt mutați în atomi de acizi. Deci, în acest caz, atomul de sulf poate dobândi electroni, prezentând putere oxidativă.
Starea atomului în care a pierdut toți electronii de valență se numește stadiul cel mai înalt de oxidare. Un atom care se află în stadiul cel mai înalt de oxidare poate fi mai puțin oxidat.
Într-o moleculă de SO 2 și un sulf elementar S, atomul de sulf este situat în faze intermediare de oxidare, atunci, având electroni de valență, atomul îi poate da, dar fără a fi completați R - Abonat, puteți primi e-mailuri până la finalizare.
Atomul elementului care se află în stadiul intermediar de oxidare poate fi identificat atât ca putere oxidativă, cât și ca putere oxidativă, ceea ce este indicat de rolul său într-o reacție specifică.
Deci, de exemplu, rolul sulfitului este anionul SO  următoarele reacții variază:
următoarele reacții variază:
5Na 2 SO 3 + 2KMnO 4 + 3H 2 SO 4 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O (1)
H 2 SO 3 + 2 H 2 S 3 S + 3 H 2 O (2)
În reacția (1) anionul sulfit SO  în prezenţa unui agent oxidant puternic, KMnO 4 joacă rolul unui captator; în reacția (2) anion sulfit SO
în prezenţa unui agent oxidant puternic, KMnO 4 joacă rolul unui captator; în reacția (2) anion sulfit SO  - agent oxidant, fragmentele de H2S pot prezenta o pierdere de putere.
- agent oxidant, fragmentele de H2S pot prezenta o pierdere de putere.
În acest fel, în mijlocul discursurilor pliate vidnovnikami pot buti:
1. Cuvinte simple, ale căror atomi conțin valori scăzute ale energiei de ionizare și electronegativității (zocrema, metal).
2. Cuvinte compuse care vor distruge atomii în stadiile inferioare de oxidare:
H Cl,H 2 S,N H 3
Na 2 S O3, Fe Cl2, Sn(NU 3) 2 .
Okislyuvachami pot buti:
1. Cuvinte simple, ale căror atomi au valori ridicate ale densității electronilor și electronegativității - nemetale.
2. Discursuri pliante care răzbună atomii în stadii superioare de oxidare: +7 +6 +7
K Mn O4, K2 Cr 207, HCI04.
3. Cuvinte compuse care înlocuiesc atomii în stadiile intermediare de oxidare:
Na 2 S O3, Mn O2, Mn SO4.
- In contact cu 0
- Google+ 0
- Bine 0
- Facebook 0



 –2
–2

 ;
;
 - 6
- 6

 ;
;
 - 8
- 8

 jurnal
jurnal

 +
2
+
2


 –4
–4

 ;
; -
6
-
6




 +
4
+
4 

 ;
; +
6
+
6


 -2
-2

 jurnal
jurnal

 +
2
+
2

 ;
;
 + 6
+ 6

 ;
; +
8
+
8